
【题目】“中国制造”“一带一路”等基础建设都需要用到大量钢铁。
(1)认识铁及其应用
①从微观看,铁是由_____(填化学符号)构成,其在地壳中的含量居所有金属元素第_____位。
②生铁和钢均是生活中常见的铁材料,它们都属于_____(填“纯净物”或“混合物”)。
③生铁可用以铸成铁锅,利用了金属铁的_____性。很多人认为:铁锅炒菜过程中摩擦产生的“铁屑”进入人体后,会与胃液中的盐酸反应,请写出铁与稀盐酸反应的化学方程式_____,该反应的基本反应类型为_____,所以用铁锅炒菜“补铁”,这里的“铁”指_____(填“原子”“单质”或“元素”),实质生成的铁为非血红素铁,人体吸收效果甚微。
(2)铁的冶炼:下图为某钢铁公司的矿石选取、冶铁和炼钢的工艺流程。
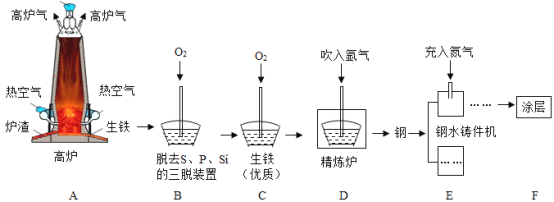
①用赤铁矿石冶铁的反应原理是_____(用化学方程式表示)。
②分析工艺流程,三脱装置中发生反应的化学方程式是_____(任写一个)。
③向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,该过程类似于化学实验中的_____操作。
④在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是_____。
(3)铁的防护
①铁制品长期暴露于潮湿的空气中,其表面易形成_____色的铁锈,由于铁绣制品的结构特点是_____,故铁制品表面的铁锈应及时清除。
②请列举一种常见的清除铁锈的方法_____。
③家庭使用的铁锅如何防锈?_____。
【答案】Fe 2 混合物 导热 Fe+2HCl=FeCl2+H2↑ 置换反应 元素 3CO+Fe2O3![]() 2Fe+3CO2 S+O2
2Fe+3CO2 S+O2![]() SO2 搅拌 用作保护气 红棕 疏松、多孔 砂纸打磨或稀酸溶锈等 使用后及时洗净擦干(烘干、涂食用油等)
SO2 搅拌 用作保护气 红棕 疏松、多孔 砂纸打磨或稀酸溶锈等 使用后及时洗净擦干(烘干、涂食用油等)
【解析】
铁与稀盐酸反应生成氯化亚铁和氢气,一氧化碳和氧化铁高温生成铁和二氧化碳,硫在氧气中点燃生成二氧化硫,磷在氧气中点燃生成五氧化二磷。
(1)①从微观看,铁是由碳原子构成,元素符号为Fe,其在地壳中的含量居所有金属元素第2位。
②生铁和钢均是生活中常见的铁材料,均含有碳等,它们都属于混合物。
③生铁可用以铸成铁锅,利用了金属铁的导热性。铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,反应符合一种单质和一种化合物生成另一种单质和另一种化合物,故该反应的基本反应类型为置换反应,元素组成物质,故这里的“铁”指元素,实质生成的铁为非血红素铁,人体吸收效果甚微。
(2)①一氧化碳和氧化铁高温生成铁和二氧化碳,故用赤铁矿石冶铁的反应原理的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
②硫在氧气中点燃生成二氧化硫,磷在氧气中点燃生成五氧化二磷,分析工艺流程,三脱装置中发生反应的化学方程式是S+O2![]() SO2。
SO2。
③向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,该过程类似于化学实验中的搅拌操作。
④在钢水铸件机中,高温钢加工成钢制零件时,氮气化学性质稳定,充入氮气的作用是用作保护气。
(3)①铁制品长期暴露于潮湿的空气中,生成氧化铁,其表面易形成红棕色的铁锈,由于铁绣制品的结构特点是疏松、多孔,故铁制品表面的铁锈应及时清除。
②稀酸和氧化铁反应生成盐和水,常见的清除铁锈的方法砂纸打磨或稀酸溶锈等。
③铁生锈是铁和氧气和水共同作用的结果,家庭使用的铁锅防锈措施是使用后及时洗净擦干(烘干、涂食用油等)。


科目:初中化学 来源: 题型:
【题目】如下图(夹持仪器已略),某兴趣小组在老师指导下,探究铁与水蒸气的反应,请回答。
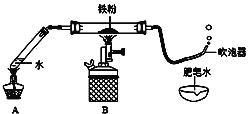
【实验初探】
(1)连接装置,并___________。
(2)装好药品。
(3)加热一段时间后,吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。
该气体燃烧的化学方程式为________。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4)。
①它们都不溶于水,其中铁粉、Fe3O4能被磁铁吸引;②FeO接触到空气会立即由黑色变为红棕色;③三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
【实验探究】实验小组同学对反应后的剩余固体进行探究。
(1)小梅发现固体为黑色,由此判断:固体中肯定不存在Fe2O3 ,理由是_______。
(2)小宇发现固体均能被磁铁吸引,大家倒出玻璃管中黑色固体,平铺于白纸上。观察现象是__________,判断黑色固体中一定没有FeO。
讨论:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【提出猜想】玻璃管中黑色固体成分有什么?
猜想Ⅰ:Fe; 猜想Ⅱ:Fe3O4; 猜想Ⅲ:______________
实验步骤 | 实验现象 | 实验结论 |
取上述固体少许,加入足量 _________________ | 出现红色固体,且有黑色固体残留 | 黑色固体中一定含有 ________________ |
【结论反思】(1)铁与水蒸气发生置换反应,反应的方程式是________________。
(2)出现红色固体的化学方程式是_______,加入的溶液必须足量的原因是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
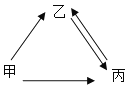
【题目】甲、乙、丙三种物质均含地壳中含量最多的元素,甲、乙是组成元素完全相同的化合物,丙是单质,乙通常为液体,在一定的条件下可分解成丙,它们之间有如图所示转化关系(部分物质和条件已略去),则甲物质是________________ ,乙生成丙的化学方程式是__________________,从微观角度解释甲乙性质有差异的原因____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁是重要的金属材料。
I.(1)下列铁制品的用途中,利用金属导热性的是_____(填字母,下同)。
A铁钳 B铁锅 C水龙头
(2)目前世界上已有 50%以上的废金属得到回收利用,其目的是_____。
A节约金属资源 B防止钢铁生锈 C减少对环境的污染
(3)全世界每年因锈蚀损失的钢铁,约占年产量的十分之一。请写出一种防止铁制品生锈的方法:____________________________。
(4)“纳米α-Fe 粉”可用于食品保鲜,称之为“双吸剂”,是因为它能够吸收空气中的___________________________________。
II.工业炼铁的设备是高炉,所用的原料有焦炭、铁矿石、石灰石等。请回答下列问题:
(1)写出以赤铁矿为原料在高温下炼铁的化学方程式:________________________________;
(2)加入焦炭,其作用除了燃烧放热提高炉温外,还能________________________________。
Ⅲ.某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究 CO 与 Fe2O3 反应后的产物。所用装置如图所示。
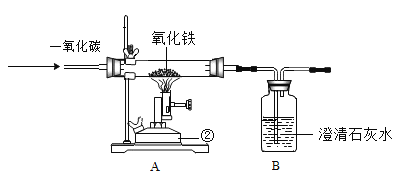
(1)如果实验成功,请回答下列问题:
①实验过程中硬质粗玻璃管内的现象:_____。
②B 装置中发生反应的化学方程式_____。
③实验开始时先向装置内通一段时间的 CO 气体,其目的是_____。
④有同学认为该装置有一明显缺陷,你认为该如何改进__________________________________________________。
Ⅳ.某钢铁公司用 2000t 含氧化铁 80%的赤铁矿石炼铁,最多可炼出含杂质 2.5%的生铁__________________________吨?(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置图,回答问题。
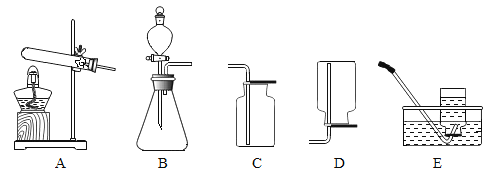
(1)实验室用双氧水和二氧化锰制取氧气的化学方程式为________________,发生装置为________(填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有______________(写一种即可)。
(2)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
(实验内容):
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g加入5mL%的H2O2溶液 | 剧烈反应,放热,产生大量气泡 | 生成物中的MnO2催化分解H2O2 |
2 | 取0. 2g MnO2加入5mL_____(填H2O2溶液的溶质质量分数)的H2O2溶液 | 平稳反应,放热,持续产生气泡 | MnO2催化分解H2O2 |
3 | 取反应后固体剩余物1. 0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | 固体剩余物中无_____ |
(实验分析):
①完善上表中的填空内容:实验2________,实验3________。
②实验2的目的是________。
③经讨论,实验1的结论不正确,理由是________。
(资料):在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:
a.![]()
b.![]()
④取8.0g KMnO4加热使之完全分解,生成O2的质量可能为________(填字母序号);
A0.81 g B1.08 g C1.42 g D1.62 g
⑤资料显示,KMnO4在43.9℃~377 .9℃范围中的失重率(O2与KMnO4的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以____(填“a”或“b”)为主。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
(实验1)按图1所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
(实验2)按图2所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。
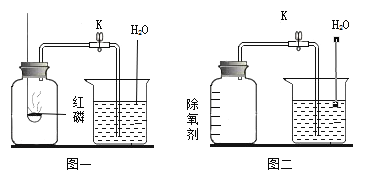
(1)实验1中,红磷燃烧的现象为_________,反应的文字或符号表达为__________。
(2)为提高实验的准确性,以上两个实验都需要注意的事项是_____(写一点)。
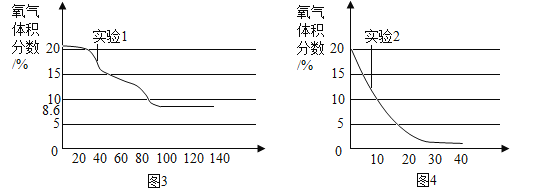
(3)实验过程中,连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3,图4信息,_____(填“实验1”或“实验2”)的测定方法更准确,判断依据是______________________。
(4)结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,该替代物应满足的条件是____________________(写两点)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家合成出羟基磷灰石[Ca5(OH)(PO4)3](相对分子质量等于502)超长纳米线,成功地研制出新型耐火纸。在1000℃的高温下,这种耐火纸仍然可以保持其完整性,使“纸能包住火”成为现实。
(1)羟基磷灰石由_____种元素组成,其中钙元素质量分数是(列出计算式即可)_____。
(2)1000℃时,羟基磷灰石在氧气中不能燃烧的原因可能是_____。
(3)用耐火纸包住燃烧的火焰,火焰熄灭,其灭火原理是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com