
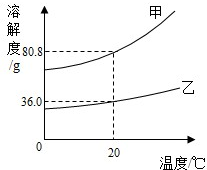
 (2012?龙岩)如图为甲和乙的溶解度曲线.下列说法正确的是( )
(2012?龙岩)如图为甲和乙的溶解度曲线.下列说法正确的是( )

科目:初中化学 来源: 题型:

 ”表示碳原子,“
”表示碳原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示硅原子.)
”表示硅原子.) 属于
属于查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
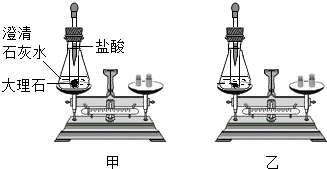
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2012?龙岩)胃酸过多须服用抗酸药物(能与盐酸反应).如图为铝碳酸镁说明书的部分内容.兴趣小组对该药物开展如下探究.
(2012?龙岩)胃酸过多须服用抗酸药物(能与盐酸反应).如图为铝碳酸镁说明书的部分内容.兴趣小组对该药物开展如下探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com