
【题目】现有工厂丢弃的废铜屑(铜屑表面呈绿色).课外活动小组同学欲利用其制取硫酸铜晶体,他们设计了下面的两种制取流程.请回答:
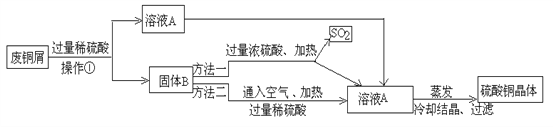
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,从组成分析,预测它除了能与稀硫酸反应后,还能与_____________(任举一例)反应。操作①所用的玻璃仪器有烧杯、玻璃棒和 ____________;溶液A的溶质有__________________;两种方法得到硫酸铜晶体,你觉得符合绿色化学要求的方法是________ 。
(2)方法二的化学反应的化学方程式为2Cu+2H2SO4+ _____= 2CuSO4+_________。
(3)硫酸铜晶体广泛应用在电镀、印染、农药等方面,波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是(用化学方程式表示)__________________________________________,此反应属于基本反应类型中的__________反应。
(4)理论上废铜屑中的铜完全可以转化为硫酸铜。已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,则废铜屑中铜的质量分数为___________ 。
【答案】 HCl等 漏斗 CuSO4、H2SO4 方法二 O2 2H2O Fe+CuSO4=Cu+FeSO4 置换 32%
【解析】(1)绿色的物质化学式是Cu2(OH)2CO3,从组成分析,含有氢氧根离子、碳酸根离子,故能与酸反应。过滤操作用到的玻璃仪器有烧杯、玻璃棒、漏斗。Cu2(OH)2CO3与硫酸反应生成CuSO4,因为加入的是过量稀硫酸,故溶液A的溶质有 CuSO4、H2SO4 。方法一中产生了空气污染物二氧化硫,故方法二符合绿色化学要求。(2)因为空气中的氧气化学性质较活泼,故是氧气参与反应,根据质量守恒定律,生成物应该是水。(3)金属活动性顺序中,铁位于铜的前面,排前置后,Fe+CuSO4=Cu+FeSO4 ,用铁制容器来配制波尔多液,会腐蚀铁制容器。单化化单是置换。(4)设废铜屑中铜的质量为x,
Cu-----CuSO4
64 160
x 80kg
![]() =
=![]() 解得x=32kg
解得x=32kg
则废铜屑中铜的质量分数为: ![]() 100%= 32%
100%= 32%


 培优口算题卡系列答案
培优口算题卡系列答案科目:初中化学 来源: 题型:
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。

(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH 7(填“大于”“小于”或“等于”)。
(2)根据曲线判断,该反应是将 (填“氢氧化钠溶液”或“盐酸”,下同)滴入 中,理由是 。
(3)当滴入溶液的体积为5 mL时,所得溶液中的溶质为 (写化学式),若在此溶液中滴入石蕊试液,溶液显 色。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某未知浓度的氢氧化钠溶液的溶质质量分数,取19.6%的稀硫酸溶液20 g,逐滴加入氢氧化钠溶液30 g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。请回答下列问题。

(1)a点溶液中的溶质的化学式是 。
(2)恰好完全反应时消耗的氢氧化钠溶液的质量为 。
(3)通过计算求出氢氧化钠溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示。根据微观示意图得出的结论正确的是

A. 该反应属于置换反应 B. 该反应中含氢元素的化合物有3种
C. 该反应中甲、乙的质量比为8∶9 D. 甲烷是由碳、氢原子构成的有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】p型透明导电化合物CuAlO2具有良好的热电性能,在热电转换领域具有广阔的应用前景。银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程。

【资料】
Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化。银在空气中不易被氧化。
请回答下列问题:
(1)CuAlO2中铜元素的化合价为______,过滤后所得滤液A中的溶质为__________。
(2)煮沸过程中发生反应的化学方程式为_____________________。
(3)固体B在煅烧时发生的其中一个反应方程式为4CuO + 2Al2O3 ![]() 4CuAlO2+X↑,气体X的化学式为__________。
4CuAlO2+X↑,气体X的化学式为__________。
(4) “煅烧”时温度须控制在1042—1085℃范围内且在氩气中进行,其原因是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
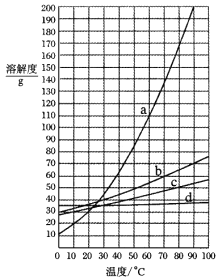
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是

A.t1℃时,甲和乙的溶解度均为30
B.t1 ℃时,甲和乙的饱和溶液中溶质质量一定相等
C.t 2℃时, 分别在100 g水中各溶解20 g甲、乙,降温后,乙溶液的溶质质量分数可能会大于甲溶液的溶质质量分数
D.t2 ℃时,在100 g水中放入60 g乙,其溶质的质量分数为37.5%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【查阅资料】盐酸是由氯化氢和水组成,盐酸的浓度是指氯化氢在盐酸中所占的质量分数。
【作出猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关。
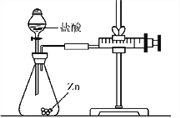
【设计探究】实验所用金属均已用砂纸打磨。
实验(1):为探究猜想a,常温下,小组同学分别在两支试管中放入相同形状、质量相等的锌片和铁片,然后分别加入质量相等、浓度相等的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。请写出放锌片的试
管中发生反应的化学方程式:____。从实验现象可初步判断:金属活动性Zn____Fe(填“<”“=”或“>”)。
【得出结论1】金属与盐酸发生反应的剧烈程度与金属本身性质有关。
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是____________________。
【实验记录】实验数据如下表:
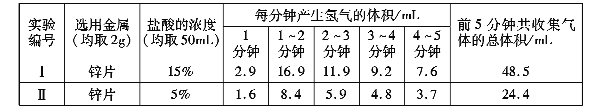
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是________________。
【反思评价】根据表中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因_______________________。通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响?____________________(写一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年甘肃省白银市】2016年4月22日,中国签署了《巴黎协定》。中国政府积极落实《巴黎协定》,引领绿色发展的举措,赢得了国际社会的积极评价。下列做法中,不符合绿色发展理念的是 ( )
A.焚烧小麦秸秆 B.垃圾分类回收 C.拒绝一次性筷子 D.发展太阳能电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com