
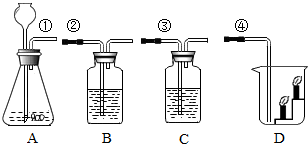
 实验室按下图所示装置制取CO2,并检验CO2的性质.试回答以下问题:
实验室按下图所示装置制取CO2,并检验CO2的性质.试回答以下问题:分析 (1)实验室制取二氧化碳用大理石和稀盐酸反应制取,大理石的主要成分是碳酸钙,据此解答;
(2)二氧化碳可使澄清的石灰水变浑浊,所以可用来检验二氧化碳,据反应原理书写方程式;
(3)根据酸性物质可使紫色的石蕊试液变红分析解答,据反应原理书写方程式;
(4)根据二氧化碳的密度比空气大,且不能燃烧、不能支持燃烧分析解答.
解答 解:(1)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应制取,大理石的主要成分是碳酸钙,它们反应的化学方程式为:CaCO3+2HCl═CO2↑+H2O+CaCl2;
(2)二氧化碳可使澄清的石灰水变浑浊,所以可用来检验二氧化碳,故装置B中应该装有的溶液为澄清石灰水;连接①和②的导管口,则A中生成的二氧化碳进入B装置,澄清的石灰水变浑浊,反应方程式是:Ca(OH)2+CO2═CaCO3↓+H2O;
(3)要证明二氧化碳与水发生反应,可利用二氧化碳与水反应生成碳酸,碳酸能使石蕊变红进行证明,所以装置C中的溶液为石蕊试液,当将标①和③的导管口连接时,C中看到的实验现象是紫色石蕊试液变红,二氧化碳和水反应方程式是:CO2+H2O═H2CO3;
(4)二氧化碳的密度比空气大,且不能燃烧、不能支持燃烧,所以将①和④的导管口连接时,会看到烧杯中下面的蜡烛先熄灭,上面的蜡烛后熄灭.
故答案为:(1)石灰石或大理石;稀盐酸;CaCO3+2HCl═CO2↑+H2O+CaCl2;
(2)澄清石灰水;澄清石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O;
(3)石蕊试液;石蕊溶液变红;CO2+H2O═H2CO3;
(4)两支蜡烛从下往上依次熄灭.
点评 本题考查了学生对二氧化碳的制取和性质的掌握和应用,考查了学生依据所学知识分析和解决问题的能力.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 |
| A | KNO3溶液 | K2CO3 | BaCl2溶液 |
| B | Fe | Cu | 稀盐酸 |
| C | CO2 | HCl | 饱和NaHCO3溶液 |
| D | FeSO4溶液 | CuSO4 | Zn |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
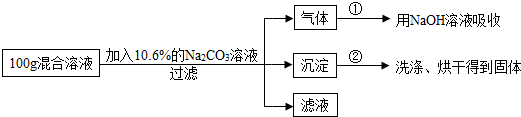
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
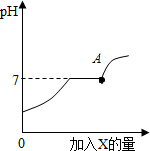
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 组成:1个二氧化碳分子比1个一氧化碳分子多1个氧原子 | |
| B. | 性质:都是无色无味的气体;都能溶于水,都能燃烧 | |
| C. | 用途:CO2用于灭火,“干冰”可用于人工降雨等;CO可作燃料、冶炼金属等 | |
| D. | 危害:CO2会造成“温室效应”;CO极易与血液中的血红蛋白结合引起中毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
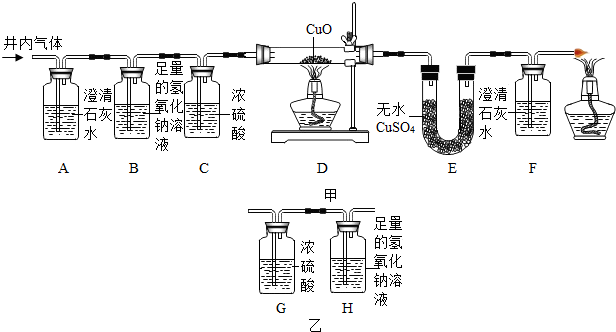
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
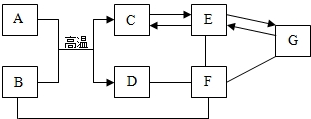 初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.
初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com