【答案】
分析:(1)从戒指的成分和探究过程中加入过量的酸来考虑答案.
(2)根据溶液的颜色和前面加入的过量的酸,说明溶液中还含有氯化铜和盐酸,这两种物质都能和铁反应并伴随不同的现象.
(3)根据金属活动性顺序的应用,排在前面的金属能把排在它后面的金属从其盐溶液中置换出来.
(4)铜锌合金最后变成了同质量的氧化铜,铜元素在反应过程中质量不变,故运用守恒法可得出“金戒指”中铜的质量分数.
解答:解:碱式碳酸铜受热易分解生成CuO、H
2O和CO
2三种物质,反应前后元素种类不变,故碱式碳酸铜是有碳,氢,氧,铜四种元素组成的.
(1)戒指的成分中有锌,故能和盐酸反应放出H
2,检验氢气的方法就是点燃,氢气能燃烧,发出淡蓝色火焰.
(2)碱式碳酸铜能和盐酸反应生成氯化铜,同时盐酸是过量的,故蓝色溶液中还含有CuCl
2 HCl等溶质;
氯化铜和铁反应能置换出红色的铜,盐酸和铁反应放出氢气,故反应现象是:①有气泡产生②有红色物质析出
(3)锌能置换出铁,铁能置换出铜,故金属活动性由弱到强为:Cu、Fe、Zn
(4)铜锌合金最后变成了同质量的氧化铜,铜元素在反应过程中质量不变,故铜在氧化铜中的质量分数就是铜在合金中的质量分数.计算方法:
CuO中Cu%=
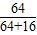
×100%=80%
3.8gCuO中mCu=3.8g×80%=3.04g
据Cu元素守恒知:3.8g“金戒指”中mCu=3.04g
“金戒指”中Cu%=
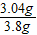
×100%=80%
故答案为:四
(1)H
2,点燃
(2)CuCl
2 HCl:①有气泡产生②有红色物质析出
(3)Cu、Fe、Zn
(4)CuO中Cu%=
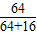
×100%=80%
3.8gCuO中mCu=3.8g×80%=3.04g
据Cu元素守恒知:3.8g“金戒指”中mCu=3.04g
“金戒指”中Cu%=
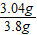
×100%=80%
点评:本题从物质的元素组成,物质的化学性质,如何分析溶液的成分,物质的检验,金属活动性顺序的应用,化学计算等方面进行考查,容量大,难易程度成阶梯上升,是一道很好的大题.

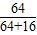 ×100%=80%
×100%=80%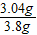 ×100%=80%
×100%=80%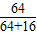 ×100%=80%
×100%=80%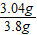 ×100%=80%
×100%=80%