
【题目】硫酸钙转化为K2SO4和CaCl2的工艺流程如图:
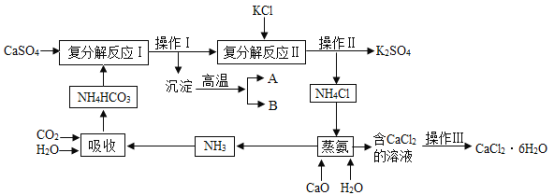
(1)吸收过程中发生了化学反应,其化学方程式为___________________。
(2)操作Ⅲ所需的玻璃仪器有___________________。
(3)蒸氨过程中一定没有涉及的反应类型是___________________(填序号)。
A 复分解反应
B 化合反应
C 分解反应
D 置换反应
(4)可循环利用的物质除了NH3外,还有_________________(填化学式)。
【答案】CO2++NH3+H2O=NaHCO3 酒精灯、玻璃棒 CD 二氧化碳和氧化钙
【解析】
(1)吸收过程中发生了化学反应,氨气、水和二氧化碳反应产生碳酸氢铵化学方程式为:CO2++NH3+H2O=NaHCO3;
(2)操作Ⅲ蒸发结晶产生氯化钙晶体,所需的玻璃仪器有:酒精灯,用于加热蒸发,玻璃棒用于搅拌,防止液体飞溅;
(3)蒸氨过程中,氧化钙与水反应产生氢氧化钙,属于化合反应;氢氧化钙与氯化铵反应产生氯化钙、水和氨气,属于复分解反应,一定没有涉及的反应类型是:分解反应和置换反应;
故选:CD。
(4)操作Ⅰ碳酸钙高温分解产二氧化碳气体和水,二氧化碳可以与氨气和水反应产生碳酸氢铵,得到可循环利用的物质除了NH3外,还有:二氧化碳和氧化钙。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:
【题目】氯化钠具有广泛的应用。
(1)实验室配制50g溶质质量分数为15%的氯化钠溶液。
①用已调节平衡的托盘天平称取氯化钠时,发现指针偏左,接下来的操作是____________。(填序号)
A 添加氯化钠 B 减少氯化钠 C 调节平衡螺母 D 添加砝码
②在量取水的体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数____________ (填>、=、<)15%。
(2)探究某氯化钠样品中杂质的成分。
某氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。甲同学的实验探究过程记录如下:
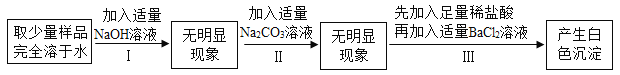
①根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是____________。
②(实验分析)
a.步骤I中加入适量NaOH溶液的目的是____________。
b.乙同学认为步骤Ⅲ中不需要加入足量稀盐酸,你是否同意他的观点?____________ (选填“同意”或“不同意”),请说明原因____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】医用双氧水可杀灭肠道致病菌、化脓性球菌,一般用于物体表面消毒。小明同学腿部擦伤,大夫在她伤口上涂了医用过氧化氢溶液,小明看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(查阅资料)
(1)过氧化氢是人体代谢废物之一,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(实验探究)
小明准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水,并用排水法。记录2分钟收集的气体体积。
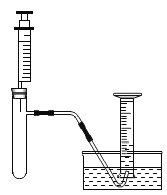
进行实验:
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | (1)__________ |
② | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次向试管中加入一小粒过氧化氢酶,然后浸在37℃的温水中 (2)第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解速率加快是因为过氧化氢酶的作用 |
(3)实验①②中,有三次收集到的气体均为5 mL,若用带火星的木条去检验这5 mL气体,观察到现象是________________。
(4)写出过氧化氢在过氧化氢酶的作用下分解的化学方程式:__________________。
(实验反思)
小明反思了实验过程,认为实验①得出的结论可能存在不足。于是他又查阅资料。科研工作者以10 mL30%的H2O2溶液为样本,加入相同的过氧化氢酶,分别做了如下9组不同的实验,所得如下数据:
序号 | 因素 | O2(ml) | ||
温度 | pH | 浸取时间 | ||
1 | 35 | 6.4 | 6 | 43.7 |
2 | 35 | 6.8 | 8 | 71.6 |
3 | 35 | 7.2 | 10 | 38.4 |
4 | 37 | 6.4 | 6 | 52.3 |
5 | 37 | 6.8 | 8 | 97.6 |
6 | 37 | 7.2 | 10 | 41.2 |
7 | 39 | 6.4 | 6 | 47.4 |
8 | 39 | 6.8 | 8 | 77.4 |
9 | 39 | 7.2 | 10 | 37.7 |
(5)综合分析表中数据,本实验最适宜条件为____组(填序号),影响过氧化氢酶发挥作用的因素有_________。酶对双氧水分解的催化作用受多个因素影响,不仅各个因素独立作用,而且因素之间有联合作用,有时个别因素对酶的抑制较强。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】质量相等的镁和铝分别和等浓度、等质量的稀盐酸反应,反应情况如图所示。则下列叙述中正确的是

A.金属均反应完,盐酸一定有剩余
B.图中a、b分别表示铝镁的反应情况
C.盐酸均反应完,镁一定有剩余
D.反应结束后,参加反应的镁和铝的质量比为4:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象与对应实验相符合的是( )
A.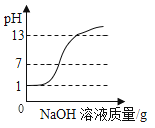 向pH=1的稀盐酸中逐滴加入pH= 13的氢氧化钠溶液
向pH=1的稀盐酸中逐滴加入pH= 13的氢氧化钠溶液
B.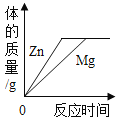 向等质量、等浓度的稀硫酸中分别加入足量的金属镁和锌
向等质量、等浓度的稀硫酸中分别加入足量的金属镁和锌
C.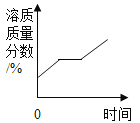 将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D.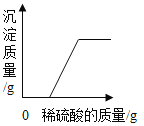 向氢氧化钾与氯化钡的混合溶液中逐滴加入稀硫酸
向氢氧化钾与氯化钡的混合溶液中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量变化趋势如图所示,下列说法正确的是( )

A.a点溶液中溶质只有AgNO3和Cu(NO3)2
B.b~c段之间的溶液中溶质只有Cu(NO3)2和Zn(NO3)2
C.取b~c段之间的溶液,滴加稀盐酸,一定有白色沉淀产生
D.取d点的固体,加入稀盐酸,一定无气泡产生
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ、挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到_____,原因是_____。
Ⅱ、不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体
(1)硝酸分解的化学方程式为:_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 |
|
|
|
实验现象 | 6分钟出现浅红棕色 15分钟红棕色比较明显 30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色 6分钟红棕色比较明显 10分钟红棕色非常明显 |
(2)实验①、②对比是研究_____对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_____。
Ⅲ、酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_____。
IV、氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是_____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有NaNO3和AgNO3的固体样品200 g,其中含银元素108 g,将该样品与一定质量的NaCl固体全部溶解于285 g水中,过滤,得到含一种溶质的滤液。计算:
(1)样品中AgNO3的质量;
(2)滤液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为晶体 M(不含结晶水)的溶解度曲线,a、b两点分别表示 M 物质的溶液,下列有关说法正确的个数有
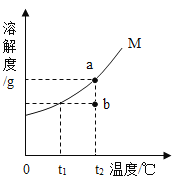
甲同学:t2时,a是饱和溶液,b是不饱和溶液,且两溶液质量相等
乙同学:将两份溶液温度降到t1时,a、b都有晶体析出
丙同学:从a![]() b:先将a降温到t1,过滤后将滤液升温到t2
b:先将a降温到t1,过滤后将滤液升温到t2
丁同学:从b![]() a:保持温度不变,在b中加入M至刚好饱和
a:保持温度不变,在b中加入M至刚好饱和
A.1B.2C.3D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com