
 Fe3O4.
Fe3O4. 2P2O5.
2P2O5. 2H2O.
2H2O. CaO+CO2↑.
CaO+CO2↑.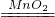 2H2O+O2↑.
2H2O+O2↑. Fe3O4
Fe3O4 2P2O5
2P2O5 2H2O
2H2O CaO+CO2↑;放热
CaO+CO2↑;放热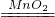 2H2O+O2↑
2H2O+O2↑

科目:初中化学 来源: 题型:
 表示氧原子、
表示氧原子、 表示碳原子,则请回
表示碳原子,则请回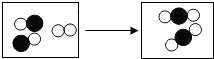
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 点燃 |
| 点燃 |
| 二氧化锰 |
| 二氧化锰 |
| -1 |
| O |
| -1 |
| O |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 化学反应 | 化学方程式 | 简答 | ||||||||
| 硫在氧气中燃烧 | S+O2
S+O2
|
产生 蓝紫 蓝紫 色的火焰 | ||||||||
| 铁在氧气中燃烧 | 3Fe+2O2
3Fe+2O2
|
反应的基本类型为 化合 化合 反应 | ||||||||
| 铁与硫酸铜溶液反应生成 铜与硫酸亚铁溶液 |
Fe+CuSO4═FeSO4+Cu Fe+CuSO4═FeSO4+Cu |
硫酸铜溶液的颜色为 蓝 蓝 色 | ||||||||
| 氯酸钾和二氧化锰制氧气 | 2KClO3
2KClO3
|
反应中二氧化锰是 催化 催化 剂 |
 表示氧原子、
表示氧原子、 表示碳原子,则该反应的化学方程式为:
表示碳原子,则该反应的化学方程式为:
| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com