
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液(或稀盐酸). | 产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑). |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加该物质 | 产生白色沉淀 | 该溶液是碳酸钠溶液.有关反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
分析 (1)氢氧化钙常温下的溶解度为0.18g,据此可计算出其饱和溶液的质量分数达不到10%,所以可判断不可能为氢氧化钙;
(2)从题目中分析,氢氧化钠、氯化钠、碳酸钠中只有氯化钠是盐,其余两种都是碱,所以应该是加入酸碱指示剂判断是否为氯化钠;
(3)鉴别氢氧化钠和碳酸钠,可以用氯化钙溶液,能产生碳酸钙沉淀,也可以采用稀盐酸,能产生气体,两种方法都可以;
(4)根据氢氧化钙和碳酸钠反应生成碳酸钙沉淀解答.
解答 解:(1)常温下氢氧化钙的溶解度为0.18g,其饱和溶液中溶质质量分数=$\frac{0.18g}{100g+0.18g}$×100%<0.18%,而该溶液溶质质量分数为10%,所以不可能是氢氧化钙;
(2)从题中分析,能使试液变红色,指示剂为无色酚酞,而氯化钠是盐,显中性,不能使无色酚酞试液变红色,可以排除氯化钠;
(3)氯化钙和稀盐酸都可以用来鉴别氢氧化钠和碳酸钠,氯化钙与碳酸钠反应产生碳酸钙白色沉淀,方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl,稀盐酸与碳酸钠反应产生二氧化碳气体,方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(4)鉴别氢氧化钠和碳酸钠还可用澄清石灰水,能产生碳酸钙沉淀,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
故答案为:(1)Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液;
(2)无色酚酞;NaCl;NaCl溶液呈中性,不能使无色酚酞试液变红色;
(3)实验步骤:氯化钙溶液(或稀盐酸);
实验现象:产生白色沉淀(或有气泡冒出);CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑);
(4)石灰水;产生白色沉淀;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
点评 本题根据氢氧化钠、氯化钠、氢氧化钙、碳酸钠几种物质的性质特点,采取“利用测定结果进行先排除,最后进行实验检验的”方法确定未知溶液,涉及对四种物质相关性质及变化规律的考查.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓盐酸、浓硫酸都能使纸张炭化 | |
| B. | CO、H2、O2、CH4均可作为燃料 | |
| C. | 烧碱溶液和石灰水都具有腐蚀性 | |
| D. | SO2、CO2、CO都可用氢氧化钠溶液吸收 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 霉变的花生、大米,经过蒸煮后食用 | |
| B. | 食品中添加大量防腐剂以延长其保质期 | |
| C. | 奶茶中加人塑化剂使其口感更香醇 | |
| D. | 食用“加铁酱油”,有利于预防缺铁性贫血 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 现象 | 结论 |
| 向氢氧化钠溶液中滴加适量的酚酞试液,再加入适量的过氧化氢溶液 | 酚酞试液变红色,后红色褪去 | 过氧化钠和水反应生成了过氧化氢 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
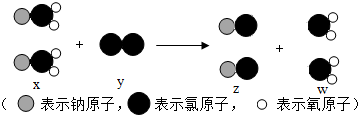
| A. | x是化合物,y单质 | |
| B. | z、w都是氧化物 | |
| C. | 该反应属于置换反应 | |
| D. | 该反应的化学方程式为:2NaClO2+Cl2═2NaCl+ClO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | HCl FeCl3 KOH ZnSO4 | B. | NH4NO3 Ba(OH)2 H2SO4 MgCl2 | ||
| C. | NaCl MgCl2 K2SO4 CuSO4 | D. | K2CO3 Na2SO4 BaCl2 NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
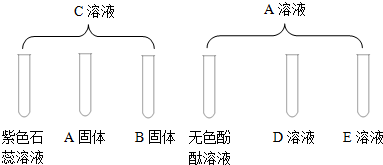
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
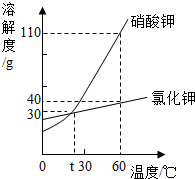 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )| A. | 硝酸钾的溶解度一定大于氯化钾的溶解度 | |
| B. | t℃时,硝酸钾溶液的浓度一定等于氯化钾溶液的浓度 | |
| C. | 把60℃时硝酸钾溶液降温至30℃,一定有硝酸钾晶体析出 | |
| D. | 60℃时,把50 g上述物质分别加入到50 g水中,充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com