
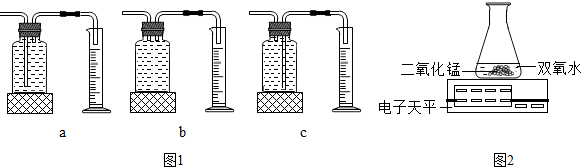
| 实验次数 | 双氧水的质量 | 双氧水的浓度 | MnO2质量 | 相同时间内产生氧气的体积(反应均未结束) |
| 1 | 50.0克 | 1% | 0.1 | 9毫升 |
| 2 | 50.0克 | 2% | 0.1 | 16毫升 |
| 3 | 50.0克 | 4% | 0.1 | 31毫升 |
分析 (1)根据双氧水在二氧化锰的催化作用下生成水和氧气以及不同的实验装置,功能不同进行解答;
(2)根据表中提供的数据可以判断影响双氧水分解速率的因素;
(3)根据单位时间内,电子天平的质量示数减少的越快,说明反应速率越快进行解答.
解答 解:(1)双氧水在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
图1装置中的c装置中,氧气通过左边导管进入瓶中,由于氧气不易溶于水,把水压入量筒中,量筒中收集的水的体积即为反应生成氧气的体积,因此本实验中,应选用图1装置中的c来测量氧气的体积.
故填:c.
(2)分析该实验数据可得:在双氧水和二氧化锰的质量相同的情况下,双氧水浓度越高,相同时间内产生氧气的体积越多,即在相同条件下,双氧水浓度越高,分解得越快.
故填:浓度越高.
(3)乙同学用图2装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢,即单位时间内电子天平的质量示数减少的越快,氧气产生的越多,双氧水分解的越快.
故填:单位时间内电子天平的质量示数减少的多少.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作:
保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/ml | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/S |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 12 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com