
分析 首先分析反应原理:因为实在密闭容器中进行反应,所以存在过量问题,因为二者可以发生反应NaOH+NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答
解答 解:由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题.
设9.2g混合物正好完全反应,减少的质量为x.
NaOH+NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O△m
124 18
9.2g x
$\frac{124}{9.2g}$=$\frac{18}{x}$
x=1.35g
因1.35g>(9.2g-8.3g),所以NaOH过量,NaHCO3完全反应.
设NaHCO3的质量为y
NaOH+NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O△m
84 18
y 18.4g-16.6g
$\frac{84}{y}$=$\frac{18}{18.4g-16.6g}$
y=4.2g
m(NaOH)=9.2g-4.2g=5g
原混合物中NaOH和NaHCO3的质量各为5克和4.2克.
点评 本题难度很大,一是判断反应过量问题,二是怎样判断过量.在判断过量中为什么1.35g>(9.2g-8.3g),就判断为氢氧化钠过量呢?因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 闻到花的香味,说明分子不断地运动 | |
| B. | 热胀冷缩,说明分子大小随温度改变而改变 | |
| C. | 水通电后生成氢气和氧气,说明在化学变化中分子可以再分 | |
| D. | 50mL的酒精和50mL的水混合后体积小于100mL,说明分子之间有间隔 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 天平指针开始偏向放铁粉的烧杯一边 | |
| B. | 两只烧杯最终可能有一只烧杯有金属剩余 | |
| C. | 天平指针最终偏向放铁粉的烧杯一边 | |
| D. | 天平最终平衡 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
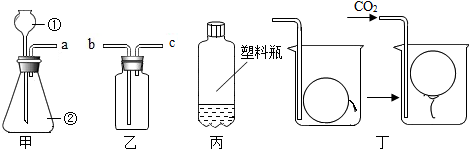
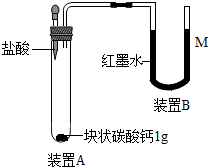 小军设计如图装置进行制取CO2的实验探究,经检验该装置气密性良好.
小军设计如图装置进行制取CO2的实验探究,经检验该装置气密性良好.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
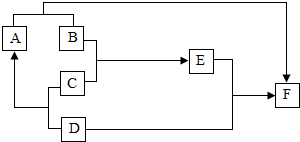 如图是某些常见物质之间转化关系,已知D为地壳中含量最多的金属元素的单质,B为氧化物,C是一种稀酸,其浓溶液用水稀释时会放出大量的热,E为蓝色溶液,A、F均为单质.试回答下列问题(框图中的反应条件和有些生成物已略去):
如图是某些常见物质之间转化关系,已知D为地壳中含量最多的金属元素的单质,B为氧化物,C是一种稀酸,其浓溶液用水稀释时会放出大量的热,E为蓝色溶液,A、F均为单质.试回答下列问题(框图中的反应条件和有些生成物已略去):查看答案和解析>>
科目:初中化学 来源: 题型:解答题
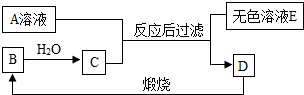 A、B、C、D是生活中常见的物质.已知A是含三种元素的钠盐,D是大理石的主要成分,它们之间的关系如图所示.请回答下列问题:
A、B、C、D是生活中常见的物质.已知A是含三种元素的钠盐,D是大理石的主要成分,它们之间的关系如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com