
| 实验操作 | 第一次实验 | 第二次实验 | 第三次实验 |
| 加入稀盐酸 | 20g | 20g | 20g |
| 剩余固体的质量 | 8g | 4g | 2g |
分析 (1)根据题意可知,20g稀盐酸能消耗4g碳酸钙,杂质不溶解也不参加化学反应,故第三次实验后剩余的固体为杂质,即可计算出石灰石中碳酸钙的质量;
(2)根据化学方程式由碳酸钙的质量可以计算出稀盐酸中溶质的质量,进而计算出所用稀盐酸中溶质的质量分数;
(3)根据质量守恒来计算反应后溶液的质量
解答 解:(1)根据题意可知,20g稀盐酸能消耗4g碳酸钙,故第三次实验后剩余的固体为杂质,碳酸钙的质量为:12g-2g=10g;故填:10g.
(2)设20g稀盐酸中溶质的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
4g x
$\frac{100}{4g}=\frac{73}{x}$
x=2.92g
所用稀盐酸中溶质的质量分数$\frac{2.92g}{20g}×$100%=14.6%;
(3)设第二次反应后生成氯化钙的质量为y,生成二氧化碳的质量为z,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
8g y z
$\frac{100}{8g}=\frac{111}{y}=\frac{44}{z}$
y=8.88g
z=3.52g
所得溶液中溶质的质量分数:$\frac{8.88g}{8g+40g-3.52g}×$100%≈10.5%
答案:
(1)石灰石中碳酸钙的质量为10g;
(2)所用稀盐酸中溶质的质量分数14.6%
(3)反应后所得溶液中溶质的质量分数19.8%.
点评 本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.


科目:初中化学 来源: 题型:选择题
| A. | 石灰水敞口放置于空气中,溶液质量增重 | |
| B. | 进入久未开启的菜窖或深洞前,要做灯火实验 | |
| C. | 人体必需元素摄入量越多越有利于人体健康 | |
| D. | 穿用合成纤维制作的内衣有利予保护皮肤 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 煤在为人类提供能源和化工原料的同时,也埋下祸根 | |
| B. | 氢气让人欢喜让人忧 | |
| C. | “煤气化”能提高市民的生产质量,同时也隐伏着无形杀手 | |
| D. | 石油是可再生能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
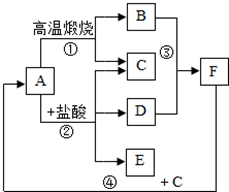 A、B、C、D、E、F为初中化学常见物质,它们之间的转化如图所示,A是固体物质,C是气体,请回答下列问题:
A、B、C、D、E、F为初中化学常见物质,它们之间的转化如图所示,A是固体物质,C是气体,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 达菲由16个碳原子、31个氢原子、2个氮原子、1个磷原子、8个氧原子构成 | |
| B. | 达菲的相对分子质量是410g | |
| C. | 达菲中各元素的质量比是192:31:28:31:128 | |
| D. | 达菲在人体内完全反应后只生成水和二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
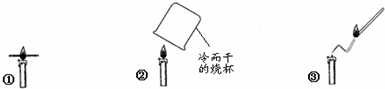
| A. | 实验前要观察物质的物理性质,这是与平时点燃蜡烛明显的不同之处 | |
| B. | 由①可以清楚地观察到外焰温度最高 | |
| C. | 由②可说明蜡烛燃烧生成了二氧化碳 | |
| D. | 由③可证明石蜡固体小颗粒可以燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com