
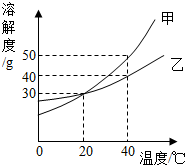
 如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )| A、20℃时,甲、乙溶液中溶质的质量分数相等 |
| B、20℃时,将60g甲加入100g水中得到溶液A,若再加入100g水,会使溶液A的质量分数变小 |
| C、40℃时,甲的饱和溶液中溶质的质量分数约为33.3% |
| D、可采用降低温度的方法,使乙的饱和溶液变为不饱和溶液 |
| 50g |
| 100g+50g |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:
 铝元素与人类关系密切.
铝元素与人类关系密切.
| ||
| 冰晶石 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、K2CO3 FeCl3 KOH H2SO4 |
| B、NaCl MgCl2 K2SO4 CuSO4 |
| C、NH4HCO3 Ba(OH)2 H2SO4 NaNO3 |
| D、K2CO3 Na2SO4 BaCl2 NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A.生活常识 | B.物质鉴别 |
| ●硬水与软水-观察颜色区别 ●人体缺钙元素-导致甲状腺肿大 |
●食盐与亚硝酸钠--品尝味道 ●硫酸铵和磷矿粉(不溶于水)--加水溶解 |
| C.安全常识 | D.“一定”与“不一定” |
| ●长时间堆放的柴草-要不时翻动 ●进入陌生溶洞前-先做灯火试验 |
●有盐和水生成的反应一定是中和反应 ●不饱和溶液转化为饱和溶液溶质质量分数一定变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com