
 Na2CO3+H2O+CO2↑ 该过程中没有涉及到的基本反应类型是______
Na2CO3+H2O+CO2↑ 该过程中没有涉及到的基本反应类型是______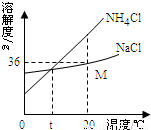
 Na2CO3+H2O+CO2↑的特点是“一变多”,符合分解反应的定义和特点,为分解反应,缺少的基本反应类型是置换反应.
Na2CO3+H2O+CO2↑的特点是“一变多”,符合分解反应的定义和特点,为分解反应,缺少的基本反应类型是置换反应.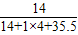 ×100%=26.2%.
×100%=26.2%.

科目:初中化学 来源: 题型:阅读理解
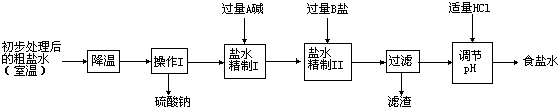
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
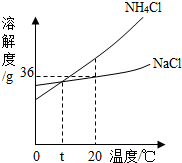 向纯碱的水溶液中滴入酚酞试液,试液变
向纯碱的水溶液中滴入酚酞试液,试液变查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
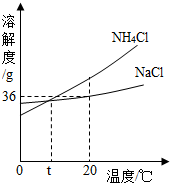 纯碱属于
纯碱属于
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com