(2011?丹阳市二模)某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO
2.他们不禁产生了疑问:书本119页的实验中,CO与Fe
2O
3反应生成的黑色物质真的是Fe粉吗?于是他们进行了以下探究.
【查阅资料】
资料一:Fe粉和Fe
3O
4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe
3O
4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe
2O
3 的形式表示;
【提出猜想】黑色物质可能是Fe
3O
4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe
2O
3反应生成的黑色物质进行了下列实验:
|
实验方案 |
实验现象 |
| 甲 |
取少量黑色物质用磁铁吸引 |
黑色物质全部被磁铁吸引 |
| 乙 |
取少量黑色物质加入30%热的盐酸中 |
无气泡、溶液颜色变成黄绿色 |
| 丙 |
取少量黑色物质加入硫酸铜溶液中 |
无任何现象 |
【实验结论】
(1)甲实验现象说明黑色物质中没有
FeO
FeO
,乙、丙实验现象说明黑色物质中没有
Fe
Fe
;
(2)生成的黑色物质应为Fe
3O
4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
Fe3O4+8HCl═FeCl2+2FeCl3+4H2O
Fe3O4+8HCl═FeCl2+2FeCl3+4H2O
;
【拓展探究】同学们对Fe
3O
4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe
3O
4粉的工艺流程简图.
【生产流程】
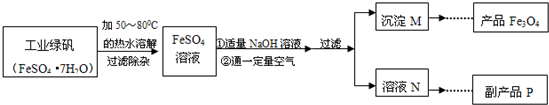
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ |
0 |
10 |
30 |
50 |
60 |
70 |
80 |
90 |
| 溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.3 |
33.0 |
30.5 |
27.0 |
资料二:Fe(OH)
2受氧气氧化反应原理为:4Fe(OH)
2+2H
2O+O
2=4Fe(OH)
3资料三:获得Fe
3O
4的反应原理为:Fe(OH)
2+2Fe(OH)
3Fe
3O
4+4H
2O
【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
.
(2)写出加入适量NaOH溶液时发生反应的化学方程式
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
;
(3)上述过程中,要控制“通一定量空气”的目的是
控制Fe(OH)2转化为Fe(OH)3的量[或防止Fe(OH)2完全转化为Fe(OH)3]
控制Fe(OH)2转化为Fe(OH)3的量[或防止Fe(OH)2完全转化为Fe(OH)3]
.
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)
2和Fe(OH)
3的最佳质量比为
90:214(或45:107)
90:214(或45:107)
.
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
c
c
→
a
a
→d.
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe
2O
3和CO反应是随温度升高而逐步进行的,先生成Fe
3O
4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe
3O
4中可能含有的杂质是Fe
2O
3和FeO中的一种或两种.
【实验设计】同学们称取了23.28g该Fe
3O
4样品进行了下列实验:
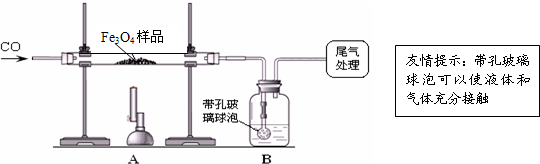
【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe
3O
4样品中的杂质.B中的最佳试剂是_
②
②
(填序号).
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③
将装置中的CO2送入NaOH溶液中
将装置中的CO2送入NaOH溶液中
.
(3)乙组同学认为B装置反应前后的
质量差会偏小而影响计算、分析,你认为他们的理由是
CO从B中溶液里逸出时会带出部分水蒸气
CO从B中溶液里逸出时会带出部分水蒸气
.
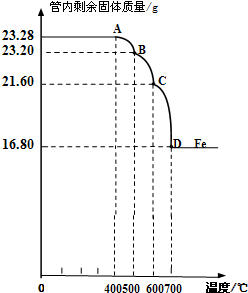
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:
.
(2)通过计算确定:该Fe
3O
4样品中含有的杂质是
Fe2O3
Fe2O3
,其中含Fe
3O
4的质量是
20.88
20.88
g.(不需要写过程)





 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是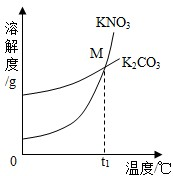 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.