
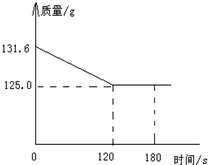
 用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应,制取二氧化碳,现将20g石灰石盛入烧杯中后,再加入111.6g稀盐酸,测得烧杯中所盛物质的质量随反应时间变化的情况如图所示试计算:
用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应,制取二氧化碳,现将20g石灰石盛入烧杯中后,再加入111.6g稀盐酸,测得烧杯中所盛物质的质量随反应时间变化的情况如图所示试计算: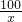 =
=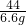
 =
=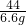
 ×100%=75%
×100%=75% ×100%=13.9%
×100%=13.9%

科目:初中化学 来源: 题型:
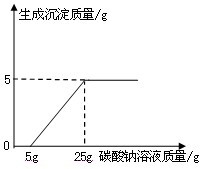 某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.查看答案和解析>>
科目:初中化学 来源: 题型:
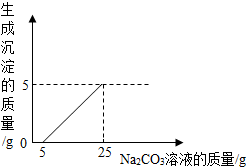 某化学小组同学用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳后,利用所得废液测定一瓶Na2CO3溶液中溶质的质量分数.他们将废液过滤,然后向滤液中慢慢滴加该Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示.(反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl).请回答:
某化学小组同学用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳后,利用所得废液测定一瓶Na2CO3溶液中溶质的质量分数.他们将废液过滤,然后向滤液中慢慢滴加该Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示.(反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl).请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:
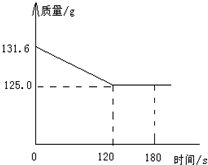 用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应,制取二氧化碳,现将20g石灰石盛入烧杯中后,再加入111.6g稀盐酸,测得烧杯中所盛物质的质量随反应时间变化的情况如图所示试计算:
用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应,制取二氧化碳,现将20g石灰石盛入烧杯中后,再加入111.6g稀盐酸,测得烧杯中所盛物质的质量随反应时间变化的情况如图所示试计算:查看答案和解析>>
科目:初中化学 来源: 题型:
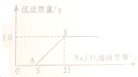 小华用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取CO2.实验完毕,他的同伴小阳决定用实验后的废液,测定桌上另一瓶Na2CO3溶液的溶质质量分数.小阳将废液过滤后,向滤液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
小华用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取CO2.实验完毕,他的同伴小阳决定用实验后的废液,测定桌上另一瓶Na2CO3溶液的溶质质量分数.小阳将废液过滤后,向滤液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com