不少家庭养观赏鱼,有时会在鱼缸里放点“鱼浮灵”,可使水中的含氧量迅速增加.请你和小欣同学一起完成这项探究活动.
探究一:“鱼浮灵”的主要成分是什么?
【查阅资料】过碳酸钠,白色结晶颗粒,易溶于水并迅速放出氧气.
【猜想假设】“鱼浮灵”的主要成分是过碳酸钠.
【设计方案】如图1
| 实验 | 主要操作步骤 | 主要实验现象 | 结论 |
| ① | 在集气瓶中加入少量 (黑色固体),在仪器a中加入新配制的“鱼浮灵”的饱和水溶液;打开仪器a的活塞,放出适量溶液后,在导管口放一根带火星的木条 |
|
“鱼浮灵”溶于水生成过氧化氢 |
| ② | 关闭仪器a,在仪器b中加入 ,打开活塞,放出适量溶液后,在导管口放一燃着的木条 | 生成大量无色气泡,木条熄灭 | “鱼浮灵”溶于水生成碳酸钠 |
【结果分析】主要成分是过碳酸钠.根据化学反应方程式:X+H
2O═Na
2CO
3+H
2O
2,推出过碳酸钠的化学式x为
.
【实验反思】(1)仪器a和b的名称是
;
(2)实验①中的化学方程式为
;
(3)实验②不严密,应该补充实验
;
(4)“鱼浮灵”的保存方法是
.
为了储存、运输、使用的方便,工业上采用醇析出将其转化成固态的过碳酸钠晶体.
探究二:工业上使用的过碳酸钠晶体(xNa
2CO
3?yH
2O
2)的组成
【设计实验】称取若干份质量为7.85克过碳酸钠晶体备用.
方案一:先测出生成的氧气的质量,求过氧化氢的质量
取一份过碳酸钠晶体溶于水,和二氧化锰固体按照如图2(方法一)装置进行装配.在将水溶液滴入试剂瓶前先称量整个装置和试剂的总质量为m
1,然后充分反应,再称量整个装置和试剂的总质量为m
2,生成的氧气的质量为
,该实验中使用碱石灰(NaOH和CaO的混合物)的作用是
.
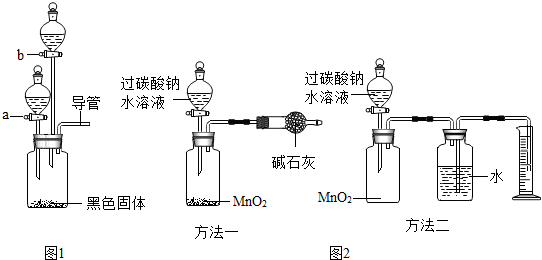
取一份过碳酸钠晶体溶于水,和二氧化锰固体按照如图2(方法二)装置进行装配,测量生成氧气的体积,进行计算得出结果.充分反应后,在量筒读数前,要调整
,再读出体积.要想得到氧气质量,还需要的数据是
.
方案二:通过测定碳酸盐沉淀的质量,进而求得碳酸钠的质量.
取一份过碳酸钠晶体溶于水,向所得溶液中滴加过量的CaCl
2溶液,过滤、洗涤、烘干,得到白色沉淀,称量.
(1)滴加的CaCl
2溶液要过量的原因是
;
(2)洗涤沉淀的目的是
;
(3)检验沉淀已经洗涤干净的方法是
,则表示已经洗净.
【实验结果】实验测得碳酸钙质量为5克,请通过计算得出过碳酸钠晶体(xNa
2CO
3?yH
20
2)的化学式.
【实验反思】若CaCO
3沉淀过滤后不洗涤,则x:y的值将
(填“偏大”、“偏小”或“无影响”).



 阅读快车系列答案
阅读快车系列答案 (1)用相应的化学符号填空
(1)用相应的化学符号填空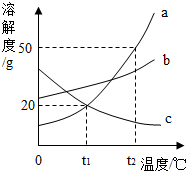 如图是a、b、c三种固体物质的溶解度曲线
如图是a、b、c三种固体物质的溶解度曲线