
(12分)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验。
实验一:比较两种物质的热稳定性
设计如右图装置:小试管套装在带有支管的大试管中,整套装置气密性好,其他装置略去。
(1)为确保安全,实验结束时,在移离酒精灯前必须完成的操作是 。
(2)现象与结论:装有碳酸氢钠的试管口生成较多的无色小液滴,同时试管A中有大量的气泡产生,澄清石灰水变浑浊;试管B中也有气泡产生,澄清石灰水没有明显的变化;实验结束后,经检验大、小两试管内的物质均是碳酸钠。结合以上实验,可得出结论:①碳酸氢钠受热生成的物质是碳酸钠、 和 。
②在受热条件下,碳酸钠比碳酸氢钠稳定。
(3)反思与讨论:加热大试管时,碳酸钠的受热温度会高于碳酸氢钠。这能否准确地说明“在受热条件下,碳酸钠比碳酸氢钠稳定”这一结论? (填“能”或“否”),理由是 。
实验二:比较与盐酸反应生成相同体积二氧化碳气体的快慢
取碳酸氢钠4.2 g放入如图Ⅰ装置的锥形瓶中,取碳酸钠5.3 g放入另一相同装置的锥形瓶中,分别加入相同质量、相同浓度的盐酸(足量)。相同的条件下,通过图Ⅱ装置测量出生成气体的体积,得到时间—体积关系曲线如图Ⅲ所示。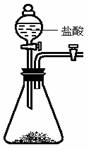


图Ⅰ 图Ⅱ 图Ⅲ
(4)已知二氧化碳不溶于该油层,图Ⅱ装置中油层的作用是 。
(5)数据与分析:根据图Ⅲ曲线,可得出有关“比较与盐酸反应生成相同体积二氧化碳气体的快慢”的结论是 。
(6)反思与讨论:实验中 “取碳酸氢钠4.2 g、碳酸钠5.3 g”的目的是
。
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:阅读理解
 23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 17、17、研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
17、17、研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
查看答案和解析>>
科目:初中化学 来源: 题型:
 某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.
某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com