
| 实验序号 | 实验 | 实验现象 |
| A | 块状石灰石放入稀盐酸中 | 产生气泡速率适中 |
| B | 块状石灰石放入稀硫酸中 | 产生气泡速率缓慢,并逐渐停止 |
| C | 碳酸钠粉末放入稀盐酸中 | 产生气泡速率很快 |
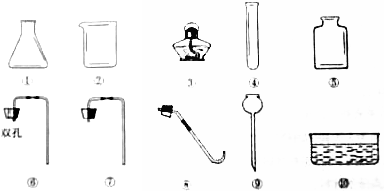
分析 (1)根据制取气体的条件考虑;(2)a.熟记常见仪器的名称;b.制取二氧化碳用碳酸钙和稀盐酸,不需要加热,收集二氧化碳的方法是向上排空气法;(3)根据固体药品的取用方法考虑;因为二氧化碳的密度比空气密度大,所以用向上排空气法收集;(4)检验二氧化碳用澄清石灰水.
解答 解:(1)制取气体的反应物反应速度适中,有利于收集,不能太快和太慢,故选A;
(2)a.⑤是集气瓶,⑩是水槽;b.制取二氧化碳用碳酸钙和稀盐酸,反应物是固体和液体,不需要加热,收集二氧化碳的方法是向上排空气法;所以选择①⑤⑥⑨;
(3)装入固体药品的操作正确的是:先将试管横放,用镊子将药品放在试管口,再将试管竖起;采用向上排气法收集二氧化碳气体,利用它的密度比空气大的性质;
(4)检验二氧化碳用澄清石灰水,反应物是氢氧化钙和二氧化碳,生成物是碳酸钙和水,所以方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
故答案为:(1)A;(2)a.集气瓶;水槽;(3)C;密度比空气大;(4)Ca(OH)2+CO2=CaCO3↓+H2O.
点评 解答本题关键是要知道发生装置的选择与反应条件和反应物的状态有关,收集装置的选择与气体的性质和密度有关.


科目:初中化学 来源: 题型:选择题
| A. | 用汽油、洗涤剂都能洗去油污,二者都是利用溶解作用 | |
| B. | 从5%的蔗糖溶液中取出1滴,这1滴溶液的浓度仍为5% | |
| C. | 酸、碱、盐的溶液能导电,是因为溶液中存在自由移动的离子 | |
| D. | 在配制溶液时,所用的溶质可以是固体、液体,也可以是气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 坚持只喝纯净水 | B. | 把浓硫酸倒入盛有水的量筒里稀释 | ||
| C. | 进入深洞时要带电筒还要打火把 | D. | 用亚硝酸钠代替食盐作调味品 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将青菜放入着火的油锅以降低其着火点 | |
| B. | 将用过的铁锅洗净擦干以防生锈 | |
| C. | 用加热煮沸的方法可降低水的硬度 | |
| D. | 用燃烧闻气味的方法可鉴别棉纤维和羊毛 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| Ⅰ | 探究溶液的浓度对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 10mL 4%H2O2 |
| Ⅱ | 25℃ | 0.2gMnO2 | 10mL 8%H2O2 |
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 实验时溶液 酸碱度 |
| Ⅰ | 探究溶液的酸碱性 对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 0mL 8%H2O2 | pH=10.0 |
| Ⅱ | 25℃ | 0.2gMnO2 | 0mL 8%O2 | pH=4.0 |
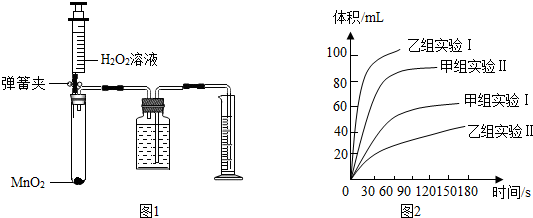
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精、乙醇、C2H5OH | B. | 小苏打、纯碱、NaOH | ||
| C. | 熟石灰、氧化钙、CaO | D. | 可燃冰、甲烷、CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com