
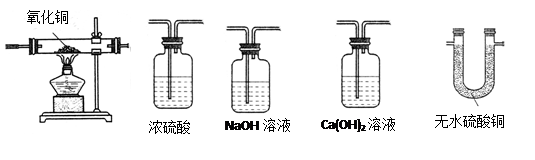
 A B C D E
A B C D E| | 有机物 的质量 | 装置的连接顺序 |  装置的质量 装置的质量 实验前 实验后 实验前 实验后 |
| 甲组 | 1.6克 | C接B | B 200克 B 202.3克 C 200克 C 201.7克 |
| 乙组 | 1.6克 | B接C | B 200克 B 201.8克 C 200克 C 202.2克 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源:不详 题型:填空题

| | 实验前 | 实验后 | |
| C(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 | O元素的质量6.4g |
| D(氯化钙+U型管)的质量/g | 110.8 | 118.0 | H2O的质量 7.2g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
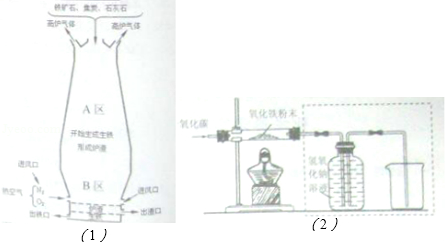
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.向洗净的碎鸡蛋壳中加入食盐水可制得二氧化碳 |
| B.用适量的水能区分氧化铜和二氧化锰 |
| C.粗盐提纯实验中,蒸发结晶至有较多固体析出时停止加热 |
| D.用pH试纸测定溶液酸碱度时,先将pH试纸用水湿润,然后再测定 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 试管号 | 1%淀粉溶液 | 1%稀硫酸 | 蒸馏水 | 碘液 |
| 1 | 2mL | 0 | 1mL | 2滴 |
| 2 | 2mL | 1mL | 0 | 2滴 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验序号 | KclO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | CO和CO2都有 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com