
分析 (1)根据氢氧化钠和氢氧化钙的性质的差异来解答,其中氢氧化钙和二氧化碳及碳酸钠反应都会生成沉淀,且氢氧化钙的溶解度随温度的降低而升高,可以据此解答该题;
(2)【猜想与假设】碳酸钠和氢氧化钙反应生成了氢氧化钠,所以在溶液中一定含有氢氧化钠,如果碳酸钠和氢氧化钙有一种量不足,则还可能含有碳酸钠或氢氧化钙,但不可能同时存在碳酸钠和氢氧化钙,可以据此作答;
【交流与评价】Na2CO3和Ca(OH)2在溶液中可以发生反应,所以不能在溶液中共存,可以据此解答;
【实验与探究】(2)丙同学猜想溶液中含有氢氧化钙,而氢氧化钙可以和二氧化碳反应生成沉淀,使溶液变浑浊,可以据此解答;
【解释与结论】如果盐酸的量不足,那么碳酸钠和盐酸反应的生成的二氧化碳马上就会和氢氧化钠反应,所以在有氢氧化钠存在的情况下,二氧化碳难以以气体的形式逸出,可以据此答题.
解答 解:(1)A、碳酸钠可以和氢氧化钙溶液反应生成白色沉淀,和氢氧化钠溶液不反应,所以可以用碳酸钠溶液来区分出氢氧化钠溶液和氢氧化钙溶液,故A能达到目的;
B、二氧化碳可以和氢氧化钙溶液反应生成白色沉淀,和氢氧化钠溶液反应时没有明显现象,所以可以用二氧化碳溶液来区分出氢氧化钠溶液和氢氧化钙溶液,故B能达到目的;
C、氢氧化钠溶液和氢氧化钙溶液都可以和稀盐酸反应,并且都没有明显的现象,故C不能达到目的;
D、氢氧化钙的溶解度随温度的升高而降低,所以加热后会由于溶解度降低而析出溶质,使溶液变浑浊,但是氢氧化钠的溶解度随温度的升高而增大,所以没有明显的现象,故D可达到目的.
故填:C.
(2)【猜想与假设】碳酸钠和氢氧化钙反应生成了氢氧化钠,所以在溶液中一定含有氢氧化钠,如果碳酸钠和氢氧化钙有一种量不足,则还可能含有碳酸钠或氢氧化钙,根据甲乙丙三位同学的猜想,如果碳酸钠溶液合氢氧化钙溶液恰好完全反应,则剩余的溶液中就只含有氢氧化钠一种溶质,故我们可以作出的假设为只含有氢氧化钠;故填:NaOH;
【交流与评价】Na2CO3和Ca(OH)2在溶液中可以发生反应,所以不能在溶液中共存,故可以判定甲的猜想是错误的;故填:甲;碳酸钠与氢氧化钙在溶液中不能共存;
【实验与探究】丙同学猜想溶液中含有氢氧化钙,而氢氧化钙可以和二氧化碳反应生成沉淀,而使溶液变浑浊,而丙同学通入二氧化碳后否定了自己的猜想,所以可以判定溶液没有变浑浊;故填:没有;
【解释与结论】在有氢氧化钠存在的情况下,碳酸钠和盐酸反应的生成的二氧化碳马上就会和氢氧化钠反应,所以在有氢氧化钠存在的情况下,二氧化碳难以以气体的形式逸出,所以为了能够观察到有气体产生,必须提供足量的稀盐酸,而本题中丁同学没有观察到气泡生成,可能是加入的盐酸的量不足造成的.故填:丁同学滴加的盐酸量过少,氢氧化钠的量较多与少量的盐酸反应.
点评 对反应后所得溶液的组成进行猜想时,首先可以确定反应后的生成物的存在,然后根据反应物的过量情况,对所得溶液进行猜想;碳酸钠能与盐酸反应,生成氯化钠和水和二氧化碳,常利用这一性质来检验氢氧化钠中是否含有碳酸钠.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:初中化学 来源: 题型:选择题

| A. | 它们表示四种元素 | |
| B. | ③表示的元素在化合物中通常显+3价 | |
| C. | ①表示的元素是金属元素 | |
| D. | ②③④表示的是阳离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石蕊试液 | B. | 硝酸银溶液 | C. | 碳酸钠溶液 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作步骤 | 实验中可能出现的现象 | 实验结论 |
| 取少量黑色固体于试管中,加入足量稀硫酸(填物质名称) | ①黑色固体消失,溶液变为蓝色 | 猜想1成立 |
| ②黑色固体没有减少,溶液颜色不变 | 猜想2成立 | |
| ③黑色固体部分消失,溶液变蓝 | 猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
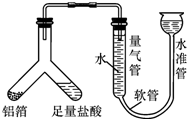 梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.| 实验一:4mL8%CuSO4溶液 | 实验二:4mL8%CuCl2溶液 | |
| 实验 现象 | 短时间内无变化,一段时间后铝片上才出现少量红色的铜 | 铝片上迅速有红色的铜出现 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
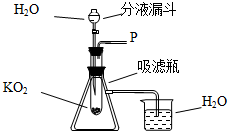 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | MFe2Ox是还原剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | SO2发生了分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com