
【题目】下表是20℃时部分物质的溶解度数据。
物质 | NaOH | AlCl3 | Al(OH)3 |
溶解度/g | 109 | 69.9 | 0.0015 |
氢氧化铝为两性氢氧化物,能与酸反应也,能与强碱反应,与氢氧化钠反应能生成偏铝酸钠(NaAlO2)和水
(1)配制溶液。其中配制20℃时100g饱和氯化铝溶液的基本步骤是:称取氯化铝固体—量取水—溶解—装瓶贴标签。
①称取氯化铝固体的质量_____________g。
②量取水加加入烧杯溶解。
③装瓶后贴标签,在标签上填写:_____________。
(2)进行性质探究实验。20℃时,根据数据回答下列问题:
①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是___________;Al(OH)3与氢氧化钠的反应方程式反应__________。
②将100g饱和氯化铝溶液,与足量的氢氧化钠反应能生成NaAlO2___________g,同时需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到0.1)
【答案】41 饱和氯化铝溶液 41% 先产生白色沉淀,过一会白色沉淀消失 Al(OH)3+NaOH=NaAlO2+2H2O 25.2g 491g
【解析】
(1)①设需要称取氯化铝固体的质量为x,则![]() ,解得x≈41g;
,解得x≈41g;
③饱和氯化铝溶液的质量分数:![]() ,装瓶后贴标签,在标签上填写:饱和氯化铝溶液 41%;
,装瓶后贴标签,在标签上填写:饱和氯化铝溶液 41%;
(2)①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是先产生白色沉淀,过一会白色沉淀消失;Al(OH)3与氢氧化钠反应生成NaAlO2和水,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
②设需要氢氧化钠的质量为x,生成NaAlO2的质量为y,
由![]() 、Al(OH)3+NaOH=NaAlO2+2H2O可得:
、Al(OH)3+NaOH=NaAlO2+2H2O可得:
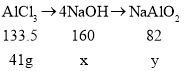
![]() x≈49.1g,
x≈49.1g,
![]() y≈25.2g,
y≈25.2g,
需10%氢氧化钠溶液的质量=49.1g![]() 10%=491g。
10%=491g。


科目:初中化学 来源: 题型:
【题目】NaNO3和KNO3的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度S/g | NaNO3 | 87.6 | 94.9 | 110 | 122 | 148 |
KNO3 | 31.6 | 45.3 | 85.5 | 110 | 167 | |
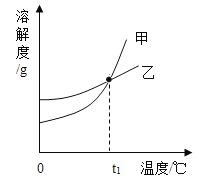
A.甲表示NaNO3溶解度曲线
B.40 ℃时,饱和溶液的溶质质量分数KNO3>NaNO3
C.t1应介于60 ℃~80 ℃
D.80 ℃时,KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用蒸发结晶、过滤等操作
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据课本实验回答下列问题:
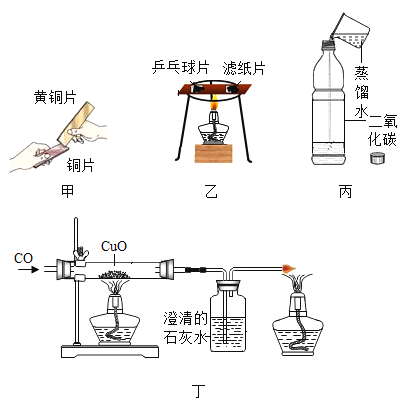
(1)甲实验中,铜片表面留下明显划痕,说明黄铜片比铜片的硬度_____(填“大”或“小”);
(2)乙实验中,乒乓球片先燃烧,滤纸片后燃烧,说明燃烧需要的条件是_____;
(3)丙实验的现象是_____;
(4)丁实验,开始时,应先_____,后_____(选填“通入CO”或“加热”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。金属镁是____________色具有金属光泽的固体;
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是____________、 固体逐渐消失、放热;
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
![]()
流程中X的化学式为_____________________。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①![]() ②氢氧化镁在热水中能部分溶解。
②氢氧化镁在热水中能部分溶解。
实验操作 | 实验现象 | 实验结论 |
将金属镁放在水中加热,再滴入几滴酚酞溶液 | 固体表面产生气泡, 液体变成___________色 | 镁能与热水反应,生成氢氧化镁和氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从微观的角度了解物质及其变化,更有助于认识物质组成和变化的本质。
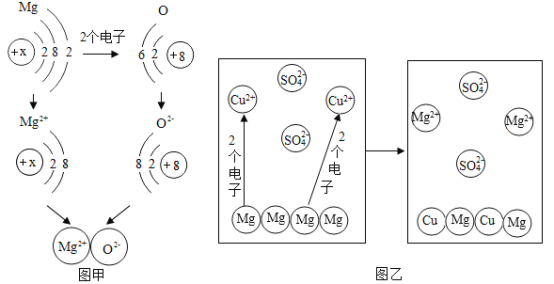
(1)图甲是镁与氧气生成氧化镁的微观示意图。
①反应中镁原子失去2个电子形成镁离子,在此过程中一定不会发生改变的是__________。
A元素种类 B元素化学性质 C最外层电子数 D原子核
②下列有关说法不正确的是__________________。
A每个镁原子失去2个电子形成镁离子,每个氧原子得到2个电子形成氧离子
B镁离子与氧离子电性相反,相互吸引,形成稳定化合物
C镁得到氧,化合价降低,发生氧化反应
(2)图乙为镁和硫酸铜溶液反应的微观示意图。写出发生反应的化学方程式______________。
(3)图丙是向20mL1.6%的氢氧化钡溶液中滴加2滴酚酞,逐滴加入2%的硫酸铜溶液时所测得溶液导电率图。该反应的微观本质是_______。M点过后溶液导电率升高的原因是_____________。
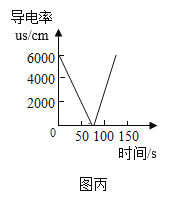
(4)若化合价发生改变的反应属于氧化还原反应,上述三个反应中属于氧化还原反应的是_______(用甲、乙、丙填写)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观与微观之间的联系,是化学学科特有的思维方式。请回答相关问题:
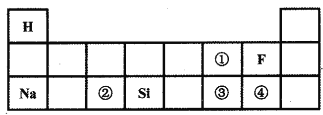
(1)下图是元素周期表的一部分,图![]() 表示图中_______处元素的原子结构示意图(填序号),在化学反应中该原子易______电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是____(填序号)。
表示图中_______处元素的原子结构示意图(填序号),在化学反应中该原子易______电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是____(填序号)。
(2)工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:
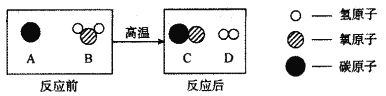
①写出该反应的化学方程式________。
②在该反应中,化合价升高的元素是_______(填元素符号,下同),化合价降低的元素是______。
③在该反应中,_____(填化学式)具有氧化性。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入烯盐酸的质量(克) | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量(克) | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是________克。
(2)所用稀盐酸中溶质的质量分数是多少________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯酸钾和高锰酸钾是初中常见的化学物质,在生活中也应用广泛,如高锰酸钾俗称“灰锰氧”,在生活中常用作消毒剂等。根据所学知识回答:
(1)氯酸钾和高锰酸钾在物质分类中属于_____(填“氧化物”、“酸”、“碱”或“盐”)。
(2)氯酸钾和高锰酸钾都可以制取氧气,是因为它们的组成中都含有相同_____。
(3)氯酸钾和高锰酸钾阳离子对应的碱都是_____(填化学式)。
(4)高锰酸钾在一定条件下能与浓盐酸反应,反应的化学方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5□↑+8H2O则“□”中的化学式为_____,其中锰元素的化合价由_____价变为_____价。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如表:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
下列说法正确的是( )
A.反应后X的质量为1.4g
B.X中一定含有碳元素和氢元素
C.X中一定含有碳元素和氧元素
D.X中两种元素的质量比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com