
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
分析 (1)根据锌和硫酸反应生成硫酸锌和氢气进行解答;
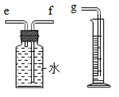
(2)为测定所收集氢气的体积,则需要采用液体等量代换的方式,因此可以选用右图这样的装置,短进长出,让里面的水等量流到量筒内,通过量筒内液体的体积判断收集的气体的体积;
(3)对比四个实验,利用控制变量法选择合适的对比组;
(3)通过不同质量分数的硫酸或不同形状的锌的产生氢气的快慢得出结论;
(4)根据表格的数据总结产生的氢气与时间的关系并分析原因;
(5)反应物浓度、反应温度、反应物接触面积、有无催化剂等因素常影响化学反应速率,利用控制变量的思想设计一个因素对反应速率的影响.
解答 解:(1)锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,故进气管是短管e,所以正确的链接顺序是:氢气→e→f→g;
(3)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒)或②④(都是锌片);通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;通过①②(锌粒和锌片与质量分数相同的硫酸反应)可以看出:锌与硫酸的接触面积越大,反应速率越快;
(4)从表格可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(5)如设计温度对反应快慢的影响,具体的操作为:取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.(只要有控制变量的意识即可);
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑;(2)e f g;
(3)①③或②④;相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快;
(4)随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)温度;温度.
点评 本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.


科目:初中化学 来源: 题型:计算题
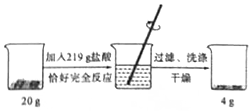 为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)
为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
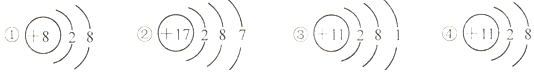
| A. | ①的化学性质比较稳定 | B. | ③④属于同种元素 | ||
| C. | ②容易得到电子 | D. | ④是一种阴离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C5H10O2 | B. | C6H6O | C. | C5H10O5 | D. | C6H12O6 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
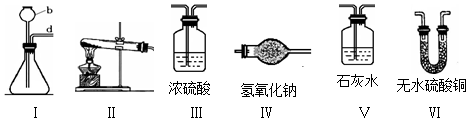
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
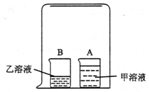 老师在课堂上演示了一个有趣的实验:在一只洁净的小烧杯A中装入30ml蒸馏水,再滴入2-3滴石蕊试液(甲溶液);在小烧杯B中装入30mL浓盐酸(乙溶液);用一个玻璃水槽把A、B两个烧杯罩在一起,一会儿就看到A烧杯中的溶液变成了红色.
老师在课堂上演示了一个有趣的实验:在一只洁净的小烧杯A中装入30ml蒸馏水,再滴入2-3滴石蕊试液(甲溶液);在小烧杯B中装入30mL浓盐酸(乙溶液);用一个玻璃水槽把A、B两个烧杯罩在一起,一会儿就看到A烧杯中的溶液变成了红色.| 实验(简述实验内容和方法) | 观察到的实验现象 |
| 1、用洁净的小烧杯取20mL水,滴入2-3滴紫色石蕊试液,观察现象; 2、取一张滤纸,滴入紫色石蕊试液,待晾干后,放在装上有浓盐酸的试剂瓶上方; 3、将少量氯化氢通入含有石蕊试液的蒸馏水中 | 不变色,水不能使石蕊试液变色; 不变色,氯化氢不能使石蕊试液变色; 变色,氯化氢溶解在水中形成的盐酸能使石蕊试液变色. |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
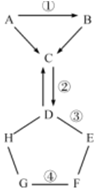 如图表示的是初中化学常见的物质A-H相互间的关系(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应).A、G都是单质,气体C常用于灭火,D是一种可溶性盐,F是一种蓝色溶液,可用于配制农药波尔多液.请你回答:
如图表示的是初中化学常见的物质A-H相互间的关系(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应).A、G都是单质,气体C常用于灭火,D是一种可溶性盐,F是一种蓝色溶液,可用于配制农药波尔多液.请你回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有②③ | C. | 只有①③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com