
| A. | 只有① | B. | 只有②③ | C. | 只有①③ | D. | ①②③ |
分析 根据金属与酸反应,金属与盐反应的条件考虑,金属能与酸反应说明排在了氢的前面,金属能与盐溶液反应,说明排在了盐中金属的前面,否则排在了盐中金属的后面.
解答 解:①Zn与硫酸反应能放出氢气,说明锌排在了氢的前面,Cu与硫酸不反应说明铜排在了氢的后面,所以锌比铜活泼,所以能比较;
②Zn和Cu都不能与MgSO4溶液反应,只能说明Zn和Cu都排在了镁的后面,但比较不出锌和铜的活泼性;
③Zn能与CuSO4溶液反应生成铜和硫酸锌,说明锌排在了铜的前面,可以比较.所以:
由上述分析可知,C正确;A、B、D错误.
故选C.
点评 氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
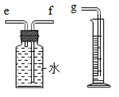 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | NH4HCO3$\frac{\underline{\;加热\;}}{\;}$NH3↑+CO2↑+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
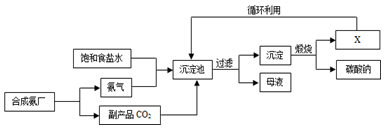
| A. | 沉淀池中的反应物共含有4种元素 | |
| B. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 | |
| C. | 图中X可能是氨气 | |
| D. | 过滤得到的“母液”中一定只含有两种溶质 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将气体分别通入澄清石灰水 | B. | 将气体分别通入石蕊试液 | ||
| C. | 试验三种气体在水中的溶解性 | D. | 将燃着的木条分别伸入三个集气瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com