
【题目】人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明它们的化学性质_____;
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①比较两种铁矿石:磁铁矿(主要成分 Fe3O4)和菱铁矿(主要成分 FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是______;
②铝制品应用广泛,不易被腐蚀,是因为______(用化学方程式来表示);
(3)镁铝合金被誉为“21 世纪绿色金属结构材料”。一种镁铝合金 Mg17All2 是特殊的储氢材料,完全吸收氢气后得到 MgH2 和 Al,该反应的化学方程式为_____;
(4)钛和钛合金是 21 世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其_____(填字母序号)非常好;
A 可塑性 B 机械性能 C 抗腐蚀性能
(5)铁在潮湿的空气中易生成疏松的铁锈。已知:2FeCl3+Fe=3FeCl2
①铁锈的主要成分是________(填化学式),将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及______种化学反应基本类型;
②将 10g 表面生锈的铁钉(杂质已忽略)浸泡在 100g 溶质质量分数为 7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为 3.6g。则原生锈铁钉中铁元素的质量分数为______;
(6)利用“活泼金属”可以制得 H2 用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有________ (填字母序号)。
A 金属原料的成本 B 生成过程中的能耗和污染 C 金属的回收利用
【答案】稳定 磁铁矿含铁量高于菱铁矿 4Al+3O2=2Al2O3 Mg17All2+17H2=17MgH2+12Al C Fe2O3 3 92% ABC
【解析】
(1)金、银在自然界有单质形式存在,说明它们的化学性质都不活泼;
(2)①在Fe3O4中铁元素的质量分数=![]() ,在FeCO3中铁元素的质量分数=
,在FeCO3中铁元素的质量分数=![]() ,从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是磁铁矿含铁量高于菱铁矿;
,从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是磁铁矿含铁量高于菱铁矿;
②铝制品应用广泛,不易被腐蚀,是因为铝在空气易形成致密而坚实氧化铝氧化膜,阻止反应进一步进行,反应的化学方程式为:4Al+3O2=2Al2O3;
(3)该反应的反应物是Mg17Al12和H2,生成物是MgH2和Al,化学方程式为:Mg17All2+17H2=17MgH2+12Al;
(4)由于钛合金抗腐蚀性能非常好,所以钛合金制品放在海水中数年,取出后仍光亮如新,故选C;
(5)①铁锈的主要成分是Fe2O3;将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中发生的反应有:Fe2O3+6HCl=2FeCl3+3H2O,该反应是两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;Fe + 2HCl = FeCl2 + H2↑,该反应是由一种单质与一种化合物生成另一种单质和另一种化合物的反应,属于置换反应:2FeCl3+Fe=3FeCl2,该反应是由两种物质生成一种化合物的反应,属于化合反应。变化过程中最多涉及三种化学反应基本类型;
②充分反应后都生成了FeCl2,根据质量守恒定律可知,FeCl2中的氯元素全部来自于盐酸,设FeCl2中铁元素的质量为x,则有:
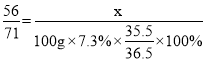 ,x=5.6;
,x=5.6;
原锈铁钉中铁元素的质量分数=![]() ;
;
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有金属原料价格是否便宜、生成过程中的能耗和污染是否大、金属是否便于回收和利用等,故选ABC。


科目:初中化学 来源: 题型:
【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动。请你参与他们的这次活动,并解决有关问题。
(提出问题)木炭与氧化铜反应除生成单质铜外,另一种生成物是什么?
(猜想与假设)猜想一:可能是CO;猜想二:可能是CO2。
(设计实验方案)
(1)检验CO2的方法是__________(用化学方程式表示)。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活。后经充分研究,认为此方案不能说明问题,其理由是____________
(查阅资料)他们在互联网上收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色。
(实验与结论)设计的实验装置图如下图所示,请完成下边的表格。
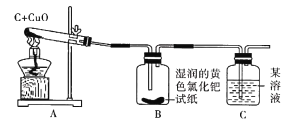
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有金属铜生成 |
B中黄色试纸没有变蓝 | 没有______生成 |
C中_________ | 有CO2生成 |
(反思与评价)如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是_____。
(注意:若答对第(3)小题奖励2分,化学试卷总分不超过40分。)
(3)对下列三种氧化铜和碳的质量比例,你建议选择_______(填序号)的比例。
A 38:3 B 40:3 C 42:3
你这样选择的理由是__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是X、Y两种固体物质的溶解度曲线。下列叙述正确的是
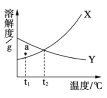
A. 温度低于t2℃时,物质Y的溶解度小于X
B. X、Y的溶解度都随温度升高而增大
C. a点表示t1℃时X、Y的溶液都、不饱和
D. Y的饱和溶液降低温度后,溶质质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质分别是高炉炼铁三种原料的主要成分,A~J 是初中化学常见的物质, 它们有如下转化关系(部分反应的生成物和反应条件已略去)。已知 B 在大气中的存在产生了温室应,H是通常状况下密度最小的气体,D 和 G 可以发生中和反应。

请回答下列问题:
(1)写出化学式: 甲______________, B______________;
(2)写出符合要求的化学方程式:
反应② ___________________,
反应③_____________________;
(3)在上述转化中,I 和 J 两种物质的组成元素相同,且反应⑤属于化合反应,则反应⑤的化学方程式为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象反映的变化规律与其对应操作不相符的是
A. 向氯化钠的饱和溶液中加入氯化钾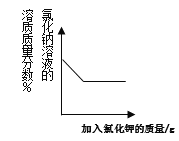
B. 向灼热的赤铁矿中通入CO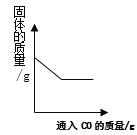
C. 向等质量的Al和Mg中加入足量的等质量等溶质质量分数的稀盐酸
D. 将饱和的氯化钠溶液恒温蒸发水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产、生活中有广泛的应用。
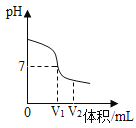
(1)氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图所示。
①根据图示判断该实验是将__________滴入到___________中。
②滴入溶液体积为V2mL时,溶液中溶质为________________(填化学式)。
(2)测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH________(填“偏大”或“偏小”)
(3)本实验要将80g10%的氢氧化钠溶液恰好完全反应,需要一定质量,一定质量分数的硫酸溶液;如果改为等质量,等质量分数的盐酸与该氢氧化钠溶液反应,则反应完滴加几滴紫色石蕊溶液后呈__________色。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从海水中制备纯碱和金属镁的流程如下图所示:
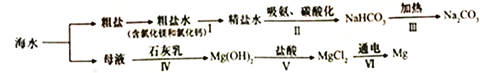
下列说法错误的是
A. 流程I依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液和适量稀盐酸去除杂质
B. 流程II吸氨是使溶液呈碱性,有利于吸收二氧化碳
C. 上述流程涉及到三种基本反应类型
D. 流程IV、V是通过化学方法富集氯化镁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图回答问题:
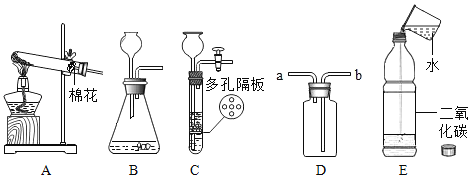
(1)请指出上述制取气体的发生装置中存在的一处错误是______,改正后用于实验室制取氧气,发生反应的化学方程式是___________ 。
(2)实验室用装置 C 制取二氧化碳的优点是___________。
(3)如图 E 装置,装满二氧化碳的塑料瓶中加入少量水后,盖紧瓶塞震荡,观察到瓶子变瘪,此现象_____(选填“能”或“不能”)证明二氧化碳与水发生了反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得21.6g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是( )
A.滤液的质量是178.4g
B.混合粉末的质量范围是5.6g<m<6.4g
C.固体中加入稀盐酸可能会有气体生成
D.原AgNO3溶液的溶质质量分数是17%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com