鉴于石油的储量有限,且汽油机和柴油机燃烧排放的尾气都严重污染大气,科学家正努力尝试采用甲醇[CH3OH]来代替部分汽油.请问:
(1)甲醇的摩尔质量为________,其中各元素的物质的量之比为________,1mol该物质含氢原子________个.
(2)该物质碳元素和氢元素的质量之比为________.氧元素的质量分数为________.
(3)该物质在空气中完全燃烧可以生成二氧化碳和水.若3.2克甲醇完全燃烧则释放二氧化碳多少mol?(提示:根据化学方程式计算写出计算过程)
解:(1)甲醇的摩尔质量是32克/摩尔.故填:32克/摩尔、甲醇[CH
3OH]碳、氢、氧元素的物质的量之比为:1:4:1;
1摩尔甲醇分子中含有4×6.02×10
23=2.408×10
24个氢原子.故填:32g/mol、1:4:1、2.408×10
24(2)甲醇中碳元素和氢元素的质量之比为:(12×1):(1×4)=12:4、氧元素的质量分数为:
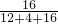
×100%=50%故填:12:4、50%
由化学方程式可知,甲醇和氧气的物质的量之比为:2:3,若要使1摩尔甲醇完全燃烧,需要消耗氧气的物质的量为1.5摩尔.故填:1.5.(1)32g/mol;1:4:1;2.408 x 10
24(2)12:4;50%
(3)解:设释放二氧化碳的摩尔量为x
2CH
3OH+3O
2
4H
2O+2CO
2 2 2
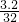
=0.1mol x
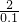
=
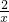
x=0.1mol
答:3.2克甲醇完全燃烧则释放二氧化碳0.1mol
分析:物质的摩尔质量在数值上等于物质的相对分子质量;每摩尔物质中含有6.02×10
23个该物质的微粒;根据反应物和生成物及其质量守恒定律可以书写化学方程式;根据化学方程式可以判断反应物和生成物的物质的量之比.
点评:解答本题要掌握化学方程式的书写方法和物质的量的含义,只有这样才能对相关方面的问题做出正确的判断.

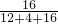 ×100%=50%故填:12:4、50%
×100%=50%故填:12:4、50% 4H2O+2CO2
4H2O+2CO2 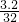 =0.1mol x
=0.1mol x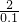 =
=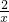


 全程金卷系列答案
全程金卷系列答案