
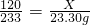

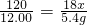


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
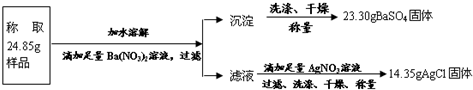
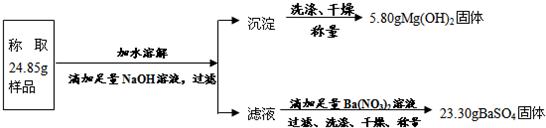
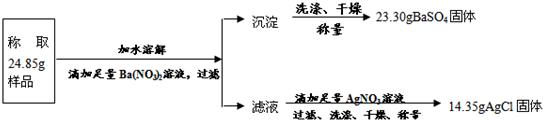
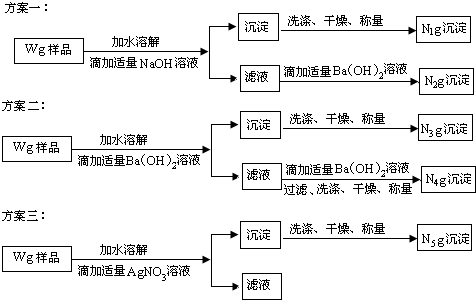
“钾泻盐”的化学式为MgSO4·KCl·xH2O,是一种制取钾肥的重要原料,它溶于水得到KCl与MgSO4的混合溶液。某化学活动小组为了测定“钾泻盐”中KCl的质量分数,设计了如下两种实验方案:

试回答下列问题:
(1)你认为方案 比较合理,理由是 。
(2)请选择上述方案中的数据,计算24.85g钾泻盐样品中MgSO4的质量。(写出计算过程) 。
(3)请选择上述方案中的数据,计算24.85g钾泻盐样品中KCl的质量分数。(写出计算过程) 。
查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州市广陵区中考化学二模试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com