
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用熟石灰中和硫酸厂的废水Ca(OH)2+H2SO4═CaSO4+2H2O 中和反应 | |
| B. | 生石灰作干燥剂CaO+H2O═Ca(OH)2 化合反应 | |
| C. | 用氢氧化钠溶液吸收二氧化碳2NaOH+CO2═Na2CO3+H2O 复分解反应 | |
| D. | 高炉炼铁4CO+Fe3O4═4CO2+3Fe 置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质(少量) | 试剂及操作方法 |
| A | CO2 | CO | 通过灼热的氧化铜 |
| B | BaCl2 溶液 | HCl | 过量的碳酸钡,过滤 |
| C | O2 | 水蒸气 | 通过浓硫酸 |
| D | MnO2 | KCl | 加入足量水溶解,过滤,将滤液蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
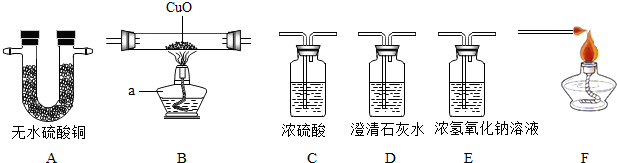
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该变化是物理变化 | B. | 该变化是化学变化 | ||
| C. | 臭氧与氧气是同一种物质 | D. | 臭氧与氧气化学性质相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

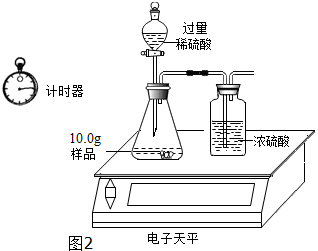
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com