
分析 (1)根据溶液的溶质质量分数公式,可求溶液中相关量,氢氧化镁与盐酸反应生成氯化镁和水,根据氯化氢的质量可以求解方程式中相关的量;
(2)根据氯化氢的质量结合方程式求解氢氧化镁的质量.
解答 解:(1)A、根据氯化氢的质量结合方程式求解氢氧化镁的质量,氢氧化镁的质量除以每片质量(1g),可得每片药物中氢氧化镁的含量;
B、根据氯化氢的质量结合方程式可以求解氯化镁的质量;
C、根据氯化氢的质量结合方程式可以求解氯化镁的质量,反应后溶液的质量为20g+1g=21g,氯化镁的质量除以21g,可得反应后溶液中氯化镁的质量分数;
D、根据20g溶质质量分数为3.65%的稀盐酸,可求氯化氢的质量20g×3.65%=0.73g,则水的质量为20g-0.73g=19.27g.
故选ABCD;
(2)设含有氢氧化镁的质量为x
Mg(OH)2+2HCl=MgCl2十2H2O
58 73
X 20g×3.65%
$\frac{58}{73}=\frac{x}{20g×3.65%}$
x-=0.58g
答:l g药物中含氢氧化镁0.58 g.
故答案为:(1)ABCD;
(2)0.58g.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 考前必练系列答案
考前必练系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别NaCl和NH4NO3固体 | 分别加少量水溶解 |
| B | 鉴别NaOH溶液和澄清石灰水 | 分别通入二氧化碳 |
| C | 除去ZnSO4溶液中混有的少量CuSO4 | 加入足量的锌粉,充分反应后过滤 |
| D | 除去K2SO4溶液中混有的少量KOH | 加入适量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 利用甲、乙两种固体物质的溶解度曲线,可以获得许多信息.
利用甲、乙两种固体物质的溶解度曲线,可以获得许多信息.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
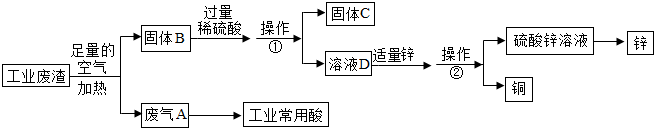
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图.
实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 周期/族 | IA | 0 | ||||||
| 1 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 He 4.003 |
| 2 | 3 Li 6.941 | 4 Be 9.012 | ① | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.81 |
| 3 | ② | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | ③ | 18 Ar 39.95 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
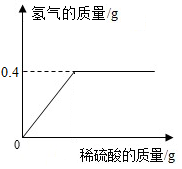 钢是铁的合金.为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应).
钢是铁的合金.为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
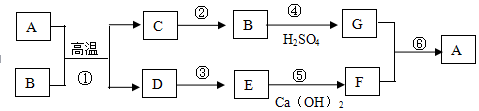
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com