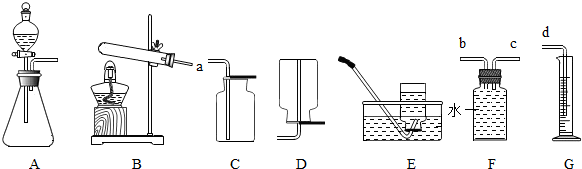
解:(1)①是试管;②是长颈漏斗;
(2)氯酸钾在二氧化锰的催化作用下分解成氯化钾和氧气,反应原理为:2KClO
3
2KCl+3O
2↑;
(3)给试管中的固体加热时试管口要略向下倾斜,防止冷凝水倒流引起试管的炸裂,因此明显的错误是:试管口向上倾斜;用加热高锰酸钾制取氧气的实验,应加一团棉花防止高锰酸钾进入导管;木炭粉还原氧化铜需要高温,所以要提高温度,可改用酒精喷灯加热;
(4)大理石和稀盐酸反应生成氯化钙、水和二氧化碳,反应的方程式为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(5)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,发生装置的特点是固液常温型,故选择B装置;根据硫化氢能溶于水的性质,不能采用排水法收集;硫化氢的密度比空气大(硫化氢的相对分子质量34>29),故采用向上排空气法收集;因为氯化氢有毒,最好要进行尾气处理.
故答案为:(1)试管;长颈漏斗;
(2)2KClO
3
2KCl+3O
2↑;
(3)试管口向上倾斜;试管口放一团棉花;把酒精灯换成酒精喷灯;
(4)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(5)B;E.
分析:(1)熟练掌握常见的化学仪器及用途;
(2)氯酸钾在二氧化锰的催化作用下分解成氯化钾和氧气;
(3)给试管中的固体加热时试管口要略向下倾斜,防止冷凝水倒流引起试管的炸裂;若用A装置来进行加热高锰酸钾制取氧气实验,应加棉花防止高锰酸钾进入导管;木炭粉还原氧化铜需要高温,所以要提高温度,可改用酒精喷灯加热;
(4)大理石和稀盐酸反应生成氯化钙、水和二氧化碳;
(5)根据反应物的状态和反应条件确定发生装置;根据气体的密度和溶解性选择收集方法.
点评:本题考查了常见气体的制取及实验的注意事项,关键是根据制取气体时反应所使用药品的状态及反应的条件,确定制取气体时应选用的发生装置;根据气体的密度与溶解性,确定气体的收集方法.


 2KCl+3O2↑;
2KCl+3O2↑; 2KCl+3O2↑;
2KCl+3O2↑;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案