

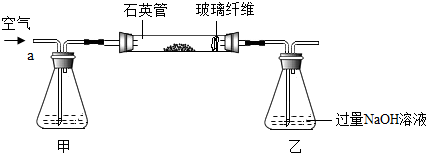
���� ��1�����ݶ�����������ɫ��ѧ�����⣬�ж�����ͼ�����漰�ı仯�����ֳ���ɫ��ѧ����ķ�Ӧ��
��2���Ӵ����ڵķ�Ӧ�Ƕ�������Ĵ�������
��3������ϡ��ǰ�����ʵ����������Լ��������;��������
��4�������������Ƶ�������������
��5����Ŀ����Ϊ������Ӧ��֮��ĽӴ������
��6������������������ԣ��ܽ������ᱵ���������ᱵ��
��7��������Ԫ�������غ�������������������ټ����������������������
��8�����ݶ�����̼�����������Ʒ�Ӧ���Լ�������Ӱ�죻
��9�����������������Ȼ�����Ӧ������
��10�����ݻ�ѧ����ʽ���������㣮
��� �⣺��1��������ɫ��ѧ�ĺ��������û�ѧԭ�������ٺ�������ҵ�����Ի�����Ӱ�죬�������ж��������ѭ��ʹ�÷�����ɫ��ѧ����������SO2ѭ�����ã�
��2������¯�����ɵĶ�����������Ϳ����е������ڽӴ����ڷ����Ĵ�������Ӧ�������������2SO2+O2$\frac{\underline{\;����\;}}{����}$2SO3��
��3������Ҫ�����ˮ������Ϊx����
100g��98%=��100g+x����10%
x=880g
ϡ������;�ȽϹ㷺�������ڽ������⡢ʵ��������ȡ�����ȣ�
���880�������⡢ʵ������������ԭ�ϵȣ�
��4������������Һ��������еĶ�����̼��Ӧ�����ȥ�������ȥ����װ�õĿ����еĶ�����̼��
��5��ͨ���������˷�Ӧ��֮��ĽӴ����������ӿ첢��ַ�Ӧ��
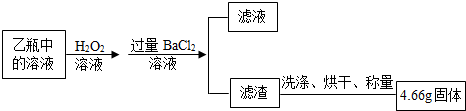
��6�����ڹ����������ǿ�����ԣ��ܽ������ᱵ���������ᱵ�����ԣ��������յõ���4.66g������BaSO4�����BaSO4�����ᱵ��
��7�������ڻ�ѧ�仯����Ԫ�������غ㣬���ԣ���Ԫ�ص�������4.66g��$\frac{32}{233}��100%$=0.64g��FeS2��������0.64g�£�$\frac{64}{120}$��100%��=1.2g����������FeS2����������Ϊ��$\frac{1.2g}{1.6g}��100%$=75%��
���75%��
��8�����ȱ�ټ�װ�ã����ڶ�����̼�����������Ʒ�Ӧ�������ղ��FeS2��������������ƫ���ƫ��
��9�����������������Ȼ�����Ӧ�����ԣ�����֤������BaCl2��Һ�����ķ����ǣ�ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ���������
���ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ���������ȡ������Һ���Թ��У�����������������ƣ�������ɫ��������˵���Ȼ�����Һ������������������ɣ�
��10���⣺������п������Ϊx��������п������Ϊ14.6g-x��п��ϡ���ᷴӦ��������������Ϊy
Zn+H2SO4=ZnSO4+H2����
65 98 2
x $\frac{98x}{65}$ y
ZnO+H2SO4=ZnSO4+H2O��
81 98
14.6g-x $\frac{98��14.6g-x��}{81}$
$\frac{98x}{65}$+$\frac{98��14.6g-x��}{81}$=196g��10%
x=6.5g
��Ϊ$\frac{65}{2}=\frac{x}{y}$
y=0.2g
�跴Ӧ����������п��������Ϊz��
����Ԫ���غ��֪��H2SO4��ZnSO4
98 161
196g��10% z
$\frac{98}{161}=\frac{196��10%}{z}$
z=32.2g
��Ӧ��������Һ��������������Ϊ��$\frac{32.2g}{14.6g+196g-0.2g}��100%$��15.3%��
�𣺷�Ӧ��������Һ��������������Ϊ15.3%��
���15.3%��
���� ��ȷ�����������ṩ�����Ϣ�ǽ����Ĺؼ���ͨ������Ŀ���ṩ��Ϣ�����������ã�������ɱ���Ľ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | ͼ1������Һһ�������� | |
| B�� | ͼ2������Һ��������������һ����� | |
| C�� | ͼ3��N��ʾ���ܽ������ | |
| D�� | ͼ2������Һ������30��һ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʴ | B�� | ��ɹ���� | C�� | ȼ���̻� | D�� | ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �˹����� | B�� |  ˮ��ե֭ | C�� |  ����������ȼ�� | D�� |  ����̿���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ���� | B�� |  ������������ | C�� |  ϡ��Ũ���� | D�� |  �ⶨҺ���pH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C+O2�TCO2 | B�� | Zn+H2SO4�TZnSO4+H2 | ||
| C�� | 2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2�� | D�� | Al+O2�TAl2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com