
【题目】氯碱工业以粗盐(主要成分是NaCl,此外还含有少量泥沙,CaCl2、MgCl2)为原料,生产氯气、氢气和氢氧化钠,模拟流程如下:
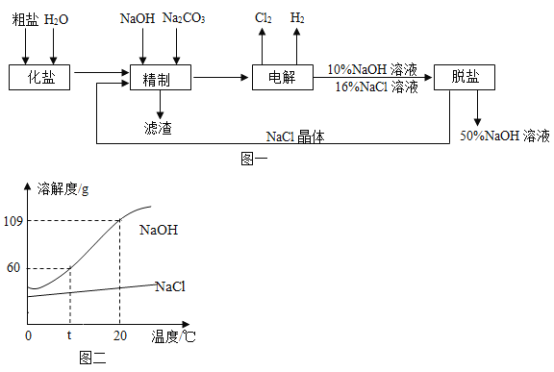
(1)图一精制过程中除去滤渣的操作是_____。
(2)图一流程中可以循环利用的物质是_____(填物质名称)。
(3)写出电解NaCl溶液的化学方程式:_____。
(4)图二为氢氧化钠和氯化钠的溶解度曲线,t℃时氢氧化钠的溶解度为_____,图一脱盐操作中除去氯化钠可以采用_____。(填“降温结晶”或“蒸发结晶”)法。
【答案】过滤 氯化钠晶体、氢氧化钠溶液 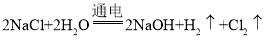 60g 蒸发结晶
60g 蒸发结晶
【解析】
(1)图一“精制”后得到固体和液体的混合物,分离固体和液体混合物的方法是过滤。故答案为:过滤;
(2)由流程图可知,脱盐后得到的氯化钠晶体可以作为精制步骤的原料,氢氧化钠溶液可作精制步骤的除杂物质。因此,图一流程中可以循环利用的物质是氯化钠晶体和氢氧化钠溶液。故答案为:氯化钠晶体、氢氧化钠溶液;
(3)由图一可知,氯化钠溶液通电时反应生成氢氧化钠、氢气和氯气,方程式为: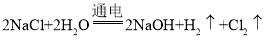 。故答案为:
。故答案为: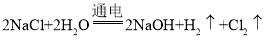 ;
;
(4)由图二可知,t℃时,氢氧化钠的溶解度为60g。氯化钠的溶解度受温度影响变化很小,氢氧化钠的溶解度受温度影响变化很大。因此,图一脱盐操作中除去氯化钠可以采用蒸发结晶的方法。故答案为:60g、蒸发结晶。


科目:初中化学 来源: 题型:
【题目】下列图像不能正确反应对应关系的是( )
A. 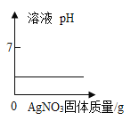 向盐溶液中加入少量AgNO3固体(忽略溶液体积变化)
向盐溶液中加入少量AgNO3固体(忽略溶液体积变化)
B. 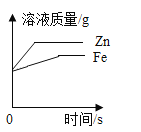 将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
C.  加热KClO3(加入少量MnO2)固体混合物制取O2
加热KClO3(加入少量MnO2)固体混合物制取O2
D. 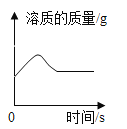 向饱和石灰水中加入少量生石灰
向饱和石灰水中加入少量生石灰
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁的氧化物有三种,分别是FeO、Fe2O3和Fe3O4。某固体粉未可能含有一种或两种铁的氧化物。取23.2克固体粉未,向其中通入足量一氧化碳并加热(假设固体完全反应),将反应生成的气体通入足量的澄清石灰水中。生成40.0克沉淀。试计算:
(l)反应生成二氧化碳的质量为多少克?(要求写出计算过程)
(2)固体粉末中含有的铁的氧化物可能为______或_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在圆底烧瓶中充满CO2,通过注射器向瓶中分别加入同体积水和NaOH溶液。利用传感器得到的气压变化如下图所示。下列说法错误的是( )
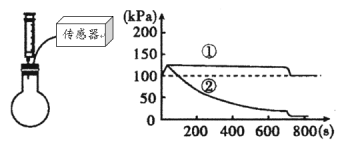
A. 800s时,曲线①表示的溶液显酸性
B. 曲线②NaOH与CO2发生的反应
C. 刚开始压强增大是因为加入液体后气体被压缩
D. 同体积水和NaOH溶液,吸收的CO2一样多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某NaCl样品中混有杂质MgCl2,为了测定样品中MgCl2的质量分数。取固体样品50.0g完全溶解于水中,并向其中逐渐加入NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如下图所示:
注:发生反应的化学方程式为MgCl2+2NaOH==Mg(OH)2↓+2NaCl
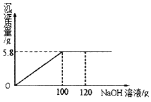
请根据相关信息完成下列计算:
(1)反应完全时生成氢氧化镁的质量_______g。
(2)样品中氯化镁的质量分数。_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】侯氏制碱法的生产过程涉及如下反应:NH3+CO2+NaCl+X=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O。下列说法错误的是( )
Na2CO3+CO2↑+H2O。下列说法错误的是( )
A. X的化学式为H2O B. NaHCO3受热易分解
C. CO2和Na2CO3中碳元素的化合价不同 D. NaHCO3分解产生的CO2可以回收再利用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~G是初中化学常见的七种物质,且A、B、C、D、E属于单质、氧化物、酸、碱、盐五种不同类别的物质,它们之间的关系如图所示。(“﹣”表示相连的物质能相互反应;“→”表示物质间的转化关系;部分反应物、生成物及反应条件未标出)。已知A物质中含有三种元素;B是单质,其组成元素在地壳中的含量位居第四;物质C的溶液呈蓝色;反应①②的现象相同,都产生白色沉淀;D、G两种物质类别相同,且都易溶于水。
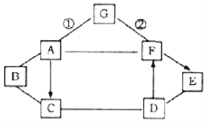
试回答:
(1)写出A、B、G的化学式:A_____、B_____、G_____。
(2)物质C在农业生产中的一种用途是_____。
(3)D与E反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸100g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液的质量与反应生成的沉淀质量关系如图所示,FeCl3与NaOH反应的化学方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.请回答下列问题。
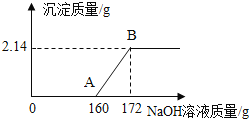
(1)A点时,溶液中的溶质是______。
(2)该工业盐酸中HCl的质量分数是多少?_____(写出计算过程)
(3)取100g该工业盐酸稀释成溶质质量分数为10%的稀盐酸,需加水______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com