
 33、碱石灰是实验室常用的干燥剂.
33、碱石灰是实验室常用的干燥剂.


科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究.
碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究. 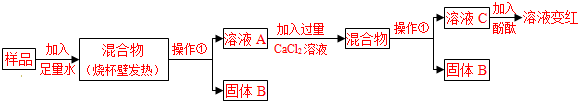
查看答案和解析>>
科目:初中化学 来源: 题型:
①碱石灰是实验室常用的干燥剂,它是氧化钙、氢氧化钠的固体混合物。 除了能吸收水蒸气外,碱石灰还能吸收常见的气体是 (9) (选填编号,只有一个答
案,多选不得分)。
A.氧气 B.一氧化碳 C.二氧化碳 D.氢气
②实验室中利用草酸亚铁晶体(FeC2O4·2H2O)受热分解得到一定量的 CO,反应的方程式 为:FeC2O4·2H2O→ 铁的氧化物+CO+CO2+2H2O

 该反应属于 (10) (填写基本反应类型), 根据质量守恒定律,可以推知产物中“铁的氧化物”的化学式是 (11) 。
该反应属于 (10) (填写基本反应类型), 根据质量守恒定律,可以推知产物中“铁的氧化物”的化学式是 (11) 。
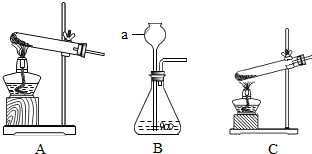
③加热草酸亚铁可选用下列“A、B、C”三套装置中的(12) (选填编号“A、B、C”)。
|
④草酸亚铁晶体的摩尔质量是 (14) (写全单位),若有 1.8g 草酸亚铁晶体充分反应可得到 CO 气体的物质的量是多少?
请写出计算过程:(15)
|
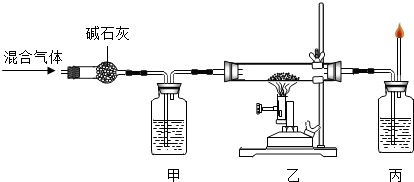
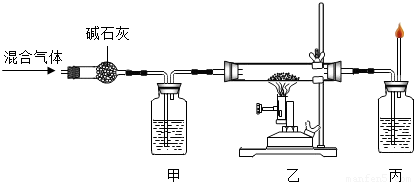
写出 “ 乙 ” 处 反应的 现象是 ( 16 ) , 反应的 化学方程式 为
 (17) ,该反应中还原剂是 (18) 。 甲、丙两处所盛放的试液分
(17) ,该反应中还原剂是 (18) 。 甲、丙两处所盛放的试液分
别是 (19) 、(20) , 其中“甲”处所盛放该试液
的作用是 (21) 。
查看答案和解析>>
科目:初中化学 来源:2012年上海市普陀区中考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com