
【题目】锰是治炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有 FeCO3、NiCO3等杂质)为原料生产金属锰的工艺流程如下图,请回答以下问题:
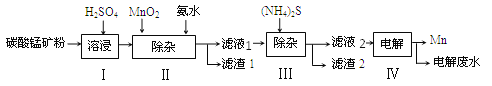
(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是_______,其中碳酸锰与硫酸反应的化学方程式为_________________。
(2)步骤Ⅱ中,先加入二氧化锰发生以下反应:MnO2+2FeSO4+2H2SO4=MnSO4+2H2O+x,x的化学式为______;已知滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,则步骤Ⅱ中加入氨水的主要目的是________。
(3)步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,则滤渣2中主要成分为______(填化学式)
(4)步骤Ⅳ中,电解后的废液中还含有Mn2+,常用石灰乳进行一级沉降得到沉淀Mn(OH)2和氨气,过滤后,再向滤液中加入Na2S进行二级沉降得到沉淀MnS。写出二级沉降过程中发生的化学反应方程式:___________________;沉降过程的产物中,______________________可循环利用于上述流程。
【答案】 增加反应物之间的接触面积,使反应更充分,同时加快反应速率 MnCO3 + H2SO4 = MnSO4 + H2O + CO2 ↑ Fe2(SO4)3 除去铁离子 NiS MnSO4+ Na2S = Na2SO4 + MnS↓ 氨气
【解析】(1)根据将碳酸锰矿研磨成粉末的主要目的是增加反应物之间的接触面积,使反应更充分,同时加快反应速率解答;根据碳酸锰与硫酸反应生成硫酸锰、水、二氧化碳解答;(2)根据质量守恒定律分析解答;根据滤液1中不含铁离子解答;(3)根据滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,NiSO4与加入的(NH4)2S反应分析解答;(4)根据MnSO4与Na2S反应,生成Na2SO4 和 MnS解答;根据题中信息可知,有氨气生成,氨气可通入步骤Ⅱ循环利用解答。(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是增加反应物之间的接触面积,使反应更充分,同时加快反应速率;碳酸锰与硫酸反应生成硫酸锰、水、二氧化碳,反应的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2 ↑;(2)反应前Mn、O、Fe、SO42-、H个数为1、2、2、4、4,反应后Mn、O、Fe、SO42-、H个数为1、2、0、1、4,反应前后Fe相差2个,SO42-相差3个,又x前的化学计量数为1,故x的化学式为Fe2(SO4)3;又滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,不含Fe2(SO4)3,则步骤Ⅱ中加入氨水的主要目的是除去铁离子;(3) 滤液1中的主要溶质为MnSO4同时还含有少量NiSO4,又步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,故NiSO4与加入的(NH4)2S反应,反应的化学方程式为NiSO4+(NH4)2S=(NH4)2SO4+ NiS↓,故滤渣2中主要成分为NiS;(4)MnSO4与Na2S反应,生成Na2SO4 和 MnS,反应的化学方程式为MnSO4+Na2S=Na2SO4 + MnS↓;由题中信息可知,有氨气生成,故氨气可循环利用于上述流程。


科目:初中化学 来源: 题型:
【题目】2014年以来,西非的一些国家暴发埃博拉病毒,致使几千人丧命。中药葛根是治疗埃博拉病毒的有效成分之一,葛根的主要成分是葛根素,它的化学式是C21H20O9,下列有关葛根素的说法正确的是( )
A. 葛根素由21个碳原子、20个氢原子和9个氧原子构成的
B. 葛根素中碳、氢、氧元素质量比是21︰20︰9
C. 葛根素的相对分子质量是416
D. 葛根素中氧元素的质量分数最大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
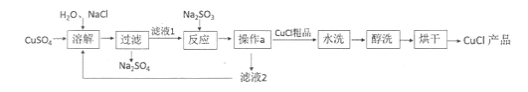
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是 、 (写离子符号)
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 。
(3)“操作a”的名称是 。本流程中可以循环利用的物质(水除外)是 。(写化学式)
(4)可用“水洗”的原因是 ,“醇洗”的目的是 。
(5)160g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)某补钙剂说明书的部分信息如下图所示。现将有20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g。

(1)青少年缺钙出现的疾病是 。
(2)该品牌补钙剂每片含的CaCO3质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)我们学习化学的目的之一就是学会从化学的视角认识和分析生活生产中的一些问题。
(1)2013 年济南市整合趵突泉、大明湖、五龙潭、护城河等旅游资源,组建天下第一泉风景区,它集独特的自然山水景观和深厚的历史文化底蕴于一体,为 5A 级景区。

①对泉水的下列说法中明显错误的是 (填序号)
A.清澈的泉水是溶液 B.蒸馏是净化程度很高的净水方法
C.可用煮沸的方法降低泉水的硬度 D.过滤可以除去泉水中的可溶性杂质
②某化学小组的小泉同学取2滴非常清澈的趵突泉水滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是
。
③济南市区居民的大部分饮用水来自地表天然水,天然水转化成饮用水需经一系列净化,Cl2是一种廉价的自来水消毒剂,与水反应生成次氯酸(HClO)有较强的杀菌作用。氯气(Cl2)和次氯酸中氯元素的化合价分别是 。
(2)化学与食品安全、环境保护、人体健康等密切相关。下列说法错误的是 (填序号)
A.在食盐中添加适量碘酸钾,补充人体所需的碘元素
B.“低碳生活”倡导大量使用化石燃料,鼓励人们多开汽车出行
C.香烟的烟气中含有许多有毒物质,吸烟有害健康
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A、B、C三种物质的溶解度曲线。下列说法不正确的是
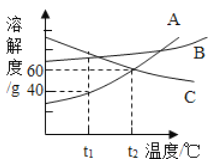
A. t1℃时,A的溶解度小于C的溶解度
B. t1℃时,100g水溶解了40gA就达到了饱和状态
C. t2℃时,A和C的饱和溶液中溶质的质量相等
D. A和B的饱和溶液从t2℃降到t1℃时,溶液的溶质质量分数都变小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下。原料石灰石中含有杂质主要是MgCO3、MgSO4 和Al2O3。
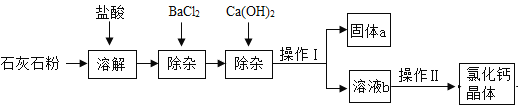
⑴石灰石粉溶解时,Al2O3发生反应的化学方程式为________________。
⑵加入BaCl2除去的杂质离子是____________(填离子符号);
⑶操作Ⅰ的名称为____________,需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、____________。操作Ⅱ的具体步骤为:____________、冷却结晶。
⑷固体a的成分一定含有________________________(只写一种)。检验溶液b的酸碱性,如果显碱性,还需加入适量的____________ (填化学式)提高产品纯度。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】微观示意图可以形象的表示物质发生的微观变化
(1)请在下图第一、三方框中把硫化氢在氧气中燃烧(2H2S+3O2![]() 2SO2+2H2O)的微观示意图补画完整。______________
2SO2+2H2O)的微观示意图补画完整。______________
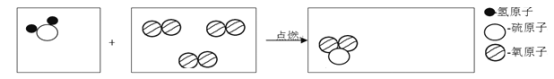
(2)在上述化学反应中,化合价不发生改变的元素是_________(填符号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:


(1)上述生产纯碱的方法称____________________,副产品的一种用途为_________________。
(2)向沉淀池中通入两种气体,先通入的是________________(填“NH3”或“CO2”),沉淀池发生的化学反应方程式是_______________________________。
(3)写出上述流程中X物质的化学式_____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____________(填“循环I”或“循环II”)。从沉淀池中取出NaHCO3沉淀的操作是__________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的_______,排除Na2CO3的干扰,再滴加___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com