
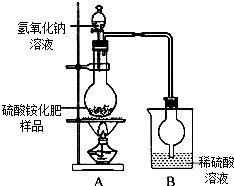
 硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)
硫酸铵是常用的一种氮肥,现有一种硫酸铵化肥,为测定其中硫酸铵的质量分数,采用如图(甲)所示的装置进行实验.已知在A、B中所发生反应的化学方程式如下:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+Na2SO4 2NH3+H2SO4═(NH4)2SO4(注:反应生成的NH3能被烧杯中的稀硫酸溶液完全吸收)分析 ①根据加入足量的氢氧化钠溶液能使硫酸铵完全反应解答;
②B增重是吸收氨气的质量,如果水进入B,则计算的数据偏大,据此解答;
②B增重的质量为生成氨气的质量,根据它算出硫酸铵的质量,再进一步求出样品中硫酸铵的质量;
解答 解:(1)往烧瓶中加入足量浓氢氧化钠溶液并充分加热可以使硫酸铵完全反应,故填:使硫酸铵完全反应;
(2)B吸收的氨气,由于有水进入,故会导致加过偏大,因此需要在AB之间加一个干燥装置,故填:A、B装置之间缺少一个干燥装置;
(3)增重的6.8g为氨气的质,设27g样品中含有(NH4)2SO4的质量为x:
(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O
132 34
x 6.8g
$\frac{132}{x}=\frac{34}{6.8g}$
x=26.4g
该化肥中硫酸铵的质量分数=$\frac{26.4g}{27g}$×100%≈97.8%
答:化肥中硫酸铵的质量分数为97.8%.
点评 本题主要考查了实验室制取氨气的实验,掌握反应原理是解答的关键,题目较综合.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 用砝码已生锈的天平称量固体药品 | |
| B. | 用湿润的pH试纸测量稀盐酸的pH | |
| C. | 称量时砝码已等于药品质量、游码未归零 | |
| D. | 用量筒量取45ml液体时,俯视读数,实际量取液体的体积 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | (NH4)2SO4,NH4Cl,NH3 | B. | NH3,(NH4)2SO4,NH4Cl | ||
| C. | NH3,NH4Cl,(NH4)2SO4 | D. | NH4Cl,(NH4)2SO4,NH3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作步骤 | 实验现象 | 结论或化学反应方程式 |
| 取少量样品于试管中,加入足量稀硫酸,将试管用导管与澄清石灰水相连. | ①产生大量气体,使澄清石灰水变浑浊. ②样品全部溶解,溶液呈蓝色. | ①样品中含有CO32-离子 ②样品中含有Cu2+离子 |
| 在上述蓝色溶液中,插入一根洁净的铁丝. | ①铁丝表面产生少量气泡. ②同时铁丝表面出现红色物质. | 写出②中的反应方程式Fe+CuSO4=Cu+FeSO4 |
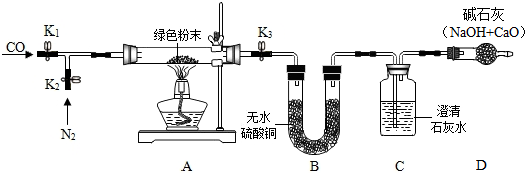
| 装置A | 装置B | 装置C | 装置D | |
| 第一次 加热后 | 绿色粉末变为黑色 | 白色粉末变蓝色 质量增加0.9g | 出现白色沉淀, 质量增加2.2g | 无明显变化 质量不改变 |
| 第二次 加热后 | 黑色粉末变红色 质量为6.4g | 无明显变化, 质量不改变 | 沉淀先增加后部分溶解; 质量增加 | 无明显变化 质量不改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com