
【题目】回答下列问题:
(1)黄铁矿为原料(主要成分是FeS2) 为原料,生产硫酸的简要流程图如下:
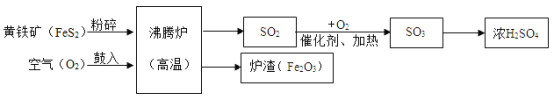
①黄铁矿中铁为+2价,则硫元素化合价是_________________。
②将黄铁矿粉碎,目的是_________________。
③实验室将所得浓硫酸稀释方法是_________________。
(2)A为含三种元素的钠盐,C为相对分子质量为100白色不溶物,请填空:
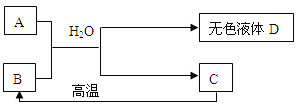
①B为食品干燥剂其化学式为___________________________;所有的转化关系中属于复分解反应的方程式为________________________________。
②要得到无色溶液D和固体C的方法是___________________________。
③无色溶液D中必定有的溶质为___________,请你设计实验证明无色溶液D中还有溶质A, ______。
【答案】-1 增大反应物接触面积,从而增大反应速率 把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌 CaO Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 过滤 NaOH 取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠
【解析】
氢氧化钙由氧化钙与水反应所得,化学方程式为CaO+H2O═Ca(OH)2;
验证溶液中含有碳酸根离子,可向溶液中滴加可溶性钙盐、可溶性钡盐或稀盐酸,如有沉淀生成或气体生成,则证明溶液中含有碳酸根离子。
(1)①二硫化亚铁(FeS2)中铁元素的化合价为+2价,根据化合物中各元素正负化合价的代数和为零,设硫元素的化合价为x,则(+2)+2x=0,解得x=-1,所以二硫化亚铁(FeS2)中硫元素的化合价为-1价;故填:-1;
②反应物颗粒越小,反应时接触面积越大,反应速率越快,所以将黄铁矿粉碎,目的是增大反应物接触面积,从而增大反应速率;故填:增大反应物接触面积,从而增大反应速率;
③稀释浓硫酸的正确操作是:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;故填:把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;
(2)根据C为相对分子质量为100的白色不溶物,所以C可能为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,B、A和水反应生成碳酸钙,A为含三种元素的钠盐,所以B为CaO,A与B反应生成碳酸钙和D,利用守恒可知A中含碳酸根,又知A为含三种元素的钠盐,所以A为碳酸钠,D为碳酸钠和氢氧化钙反应生成的氢氧化钠。经验证,推导正确。
①B为氧化钙,可用于食品干燥剂,化学式为CaO;A、B和水反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,碳酸钙高温煅烧生成二氧化碳和氧化钙,属于分解反应;故填:CaO;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
②要将无色溶液D和固体C分离,方法是过滤;故填:过滤;
③D溶液为碳酸钠和氢氧化钙反应后所形成的溶液,依据Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,反应后溶液一定含有NaOH;要证明无色溶液D中还有溶质碳酸钠,可以取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠。因为碳酸钠和氯化钙反应生成碳酸钙沉淀。故填:NaOH;取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:初中化学 来源: 题型:
【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是氢离子与氢氧根离子生成水。像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤:(以Na2SO4溶液与BaCl2溶液反应为例)
①写出反应的化学方程式: ![]()
②把易溶于水、易电离的物质写成离子形式,而把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成: ![]()
③删去方程式两边不参加反应的离子:2Na+ 、2C1-
④硫酸钠溶液与氯化钡溶液反应的离子方程式为: ![]()
⑤检查方程式两边各元素的原子个数和电荷总数是否相等。
请写出:向硫酸铜溶液中滴加氢氧化钠溶液所发生反应的离子方程式________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种物质,有下图所示关系,“→”表示可以向箭头所指方向转化,通常情况下F是一种无色液体,G是一种黑色固体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变。试推断:
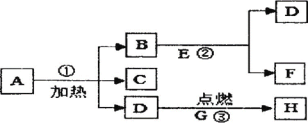
(1)写出物质 A 的颜色_____
(2)写出反应①、③的化学方程式:①_____③_____
(3)反应③的基本反应类型是______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)原混合物中氯酸钾的质量是多少?_____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是

A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国农村大力推广使用沼气。
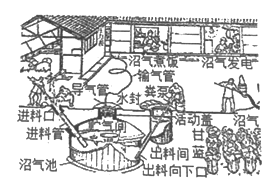
(1)沼气的主要成分燃烧的化学方程式是__________。
(2)用沼气作燃料是把______转化为热能,与直接用秸杆作燃料相比,前者的一个优点是________。
(3)从安全方面考虑,使用沼气时一定要防止沼气中混入_______。
(4)在用沼气煮饭时,燃气灶的火焰正常情况下呈_____色,有时火焰呈现黄色,锅底出现黑色,此时需要调大炉具的______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝苯地平控释片是一种治疗高血压药物,其主要成份为硝苯地平(C17H16N2O6)。 请回答下列问题:

(1)“硝苯地平控释片”属_____________(填“纯净物”或“混合物”)。
(2)“硝苯地平”由______________种元素组成,各元素的质量比为________________。
(3)从“硝苯地平控释片”的贮藏方法和警示语中可判断“ 硝苯地平”可能的化学性质是___________。(只填写一种)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液 pH 随滴入溶液体积变化的曲线。

(1)氢氧化钠和盐酸恰好完全反应时,溶液的 pH_____7 (填“大于”或“小于”或“等于”),该反应的化学方程式为_____。
(2)根据曲线判断,该反应是将_____(填“氢氧化钠”或“盐酸”)滴入另一种物质中。
(3)当滴入溶液的体积为 5mL 时,此时该溶液中的溶质是_____(填化学式)。
(4)将 80g 10%的氢氧化钠溶液与一定质量的 10%的稀盐酸相混合,充分振荡后,滴入几滴石蕊溶液,溶液呈紫色,则稀盐酸的质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
(实验探究)
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是______。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2:溶液有白色沉淀产生,该反应的化学方程式为______。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈______色,证明溶液X中有NaOH剩余,实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是______。
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示,图1中,BC段发生反应的化学方程式为______。图2中,DE段温度变化的原因是______。
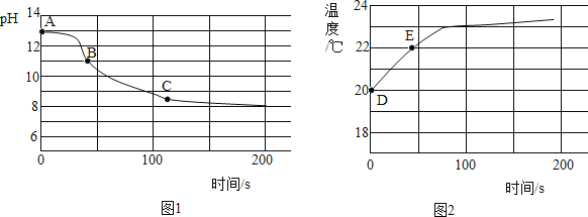
(反思感悟)(5)实验从CO2减少,NaOH减少,Na2CO3生成等物质的变化,以及能量转化等视角多维度探究CO2与NaOH发生了反应,对现象不明显的化学反应,可以过现代技术手段进行数据测定,实现反应过程的“可视化”。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com