
【题目】为了探究碳酸钙与稀盐酸的接触面积对反应速率的影响,某化学兴趣小组的同学进行了如下实验。
(进行实验)按图所示的装置进行实验,倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测定瓶内的气压随时间的变化如图所示。
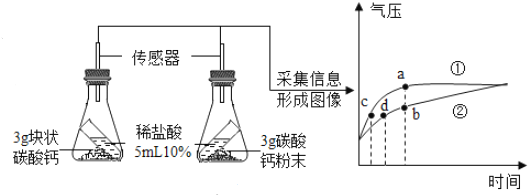
(实验分析)(1)碳酸钙与稀盐酸反应的化学方程式为_____。
(2)对比分析![]() 、
、![]() 两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析
两点可知,______曲线表示粉末状碳酸钙和稀盐酸反应;对比分析![]() 、
、![]() 两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
两点可知,相同气压时,_____(选填“粉末状”或“块状”)碳酸钙与稀盐酸反应速率更快。
(3)由图可知,碳酸钙粉末产生的CO2____(选填“大于”“小于”或“等于”)块状碳酸钙产生的CO2。
(实验结论)碳酸钙与稀盐酸的接触面积越大,反应速率越快。
(4)还有哪些因素影响碳酸钙与稀盐酸反应的快慢,请提出猜想,并设计实验方案进行验证。
猜想:______;
实验方案______。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ a 粉末状 等于 所用盐酸的质量分数影响碳酸钙与稀盐酸反应的快慢 向两只锥形瓶内各加入3g块状碳酸钙,再向一只锥形瓶内加入5mL10%的稀盐酸,向另一只锥形瓶内加入5mL5%的稀盐酸,测量产生等量二氧化碳气体所需的时间
【解析】
(1)碳酸钙与稀盐酸反应生成氯化钙水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)对比分析![]() 、
、![]() 两点可知,曲线a单位时间内气压大,说明单位时间内产生的气体多,反应速率快,故a曲线表示粉末状碳酸钙和稀盐酸反应;对比分析c、d两点可知,相同气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,故粉末状碳酸钙与稀盐酸反应速率更快;
两点可知,曲线a单位时间内气压大,说明单位时间内产生的气体多,反应速率快,故a曲线表示粉末状碳酸钙和稀盐酸反应;对比分析c、d两点可知,相同气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,故粉末状碳酸钙与稀盐酸反应速率更快;
(3)由图可知,最终曲线a、b的气压相等,说明最终产生二氧化碳的量相等;
(4)猜想:所用盐酸的质量分数影响碳酸钙与稀盐酸反应的快慢;
实验方案:向两只锥形瓶内各加入3g块状碳酸钙,再向一只锥形瓶内加入5mL10%的稀盐酸,向另一只锥形瓶内加入5mL5%的稀盐酸,测量产生等量二氧化碳气体所需的时间。


 习题精选系列答案
习题精选系列答案科目:初中化学 来源: 题型:
【题目】下列是四种微粒的结构示意图,有关说法正确的是( )
A. 它们表示四种元素的不同粒子
B. ②④形成化合物的化学式为Na2O
C. 图①表示的微粒在化学反应中易得到电子变成阳离子
D. 以上微粒结构示意图所表示的元素均位于元素周期表中的第二周期
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,与人类生活息息相关,人类的日常生活和工农业生产离不开水。请回答:
(1)某地下水中含有较多可溶性钙、镁矿物质,该水属于________(填“软水”或“硬水”)。
(2)自然界中的水一般要净化后才能使用,在沉降、过滤、吸附、蒸馏等净水方法中,单一操作相对净化程度最高的是____________。
(3)从海水中提炼出来的重水(化学式为D2O)中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为___________。
(4)用铝制水壶在煤气灶或煤炉上烧水是利用了铝的_________性。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明要配制100 g溶质质量分数为18.5%的氯化钠溶液,如图是他配制该溶液的示意图.

(1)图中共有______处错误(说明:天平的两个托盘上都垫有纸).
(2)量取所需要的水应选择______(选填“10mL”、“50mL”或“100mL”)量筒.
(3)用图示的序号表示配制溶液的操作顺序:______.
(4)下列因素会使所配溶液溶质质量分数偏小的是______(填序号)
①药品和砝码放错了盘 ②量取水时仰视量筒刻度 ③所用烧杯内事先残留少量蒸馏水 ④将所配溶液转入试剂瓶时,不慎洒到外面少量.⑤使用粗盐代替氯化钠进行配制.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使得低温产氢工业取得 了新突破,反应过程如图所示。下列说法正确的是
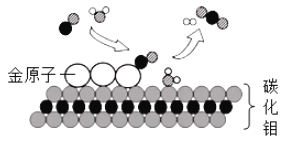
A. 反应的化学方程式为CO2+H2=H2O+CO
B. 金原子对CO起吸附催化作用
C. 碳化钼在反应前后化学性质发生了改变
D. 反应中分子的数目发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知:2CO2+2Na2O2═2Na2CO3+O2.在密闭容器中,将 6.6g CO2 与一定量的 Na2O2固体充分反应后,气体变为3.8g.下列说法正确的是( )
A. 3.8g气体全部是O2
B. 剩余CO2的质量是2.2g
C. 反应后的固体是混合物
D. 生成Na2CO3的质量是15.9g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组用KCIO3和MnO2的混合物加热制取O2,收集到4.8gO2后停止加热,称得剩余固体的质量为28.0g,继续加热至不再产生O2,最终剩余固体质量为23.2g,试计算(不考虑O2的损耗);
(1)两次生成O2的总质量为 g;
(2)理论上可回收到MnO2的质量(写出计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式符合题意且书写正确的是( )
A. 铁在氧气中燃烧:2Fe+3O2![]() 2Fe2O3
2Fe2O3
B. 酸雨形成的原因:CO2+H2O![]() H2CO3
H2CO3
C. 铜片加入硝酸汞溶液反应:Cu+Hg(NO3)2=Cu(NO3)2+Hg
D. 将少量铁粉投人稀盐酸:2Fe+6HC1=2FeCl3+3H2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】绍兴市获得2015年度全省“五水共治”工作优秀市并被授予大禹鼎,“五水共治”是指治污水、防洪水、排涝水、保供水、抓节水,还社会一个蓝天碧水,为百姓创造美好的生活环境。
某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl﹣、NO3﹣,已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是 。
(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。

操作I的名称是 ,单质A是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com