
| 甲 | 乙 | 丙 | 丁 | |
| 反应前质量分数/% | 70 | 15 | 6.25 | 8.75 |
| 反应后质量分数/% | 35 | 7.5 | 48.75 | 8.75 |
| A. | 丁一定是这个反应的催化剂 | |
| B. | 参加反应的甲和乙的质量之和一定等于生成的丙的质量 | |
| C. | 甲一定是化合物,乙一定是单质 | |
| D. | 该反应可能是分解反应 |
分析 此题是借助质量守恒定律对反应物生成物先做出判断,再利用质量关系进行求解,反应中反应物质量会减少,生成物质量会增加,从而判断生成物与反应物,即可判断反应的类型.
解答 解:A、丁在反应前后质量没有变化,可能为该反应的催化剂,也有可能是杂质,没有参加反应,故A错误;
B、甲反应后质量减少70-35=35g,为反应物,乙质量减少15-7.5=7.5g,为反应物,丙质量增加48.75-6.25=42.5g,故B正确;
C、由B分析可知,该反应的化学方程式为:甲+乙=丙,丙一定是化合物,甲和乙都有可能是单质,也有可能是化合物,故错误;
D、由B分析可知,该反应的化学方程式为:甲+乙=丙,故为化合反应,故错误.
故选B
点评 此题是有关质量守恒定律的考查题,解题的关键是利用质量守恒定律对相关量的分析与判断,并进而对反应的类型及质量关系进行探讨.


科目:初中化学 来源: 题型:解答题
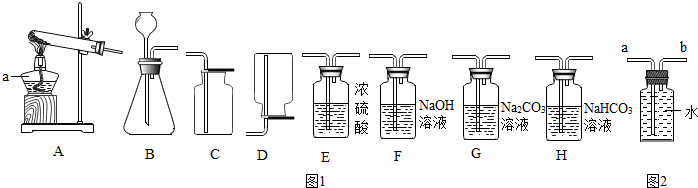
| 实验步骤 | 实验现象 | 实验结论 |
| 气体中有HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
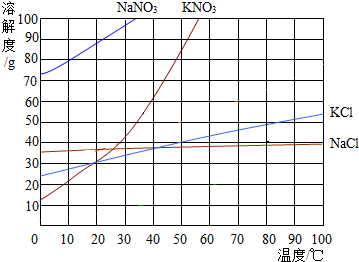 如图为几种固体的溶解度曲线,回答下列问题:
如图为几种固体的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 甲物质的溶液可用作化肥、电镀液等.甲的溶解度曲线如图所示,下列说法正确的是( )
甲物质的溶液可用作化肥、电镀液等.甲的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度是102.5g | |
| B. | 甲的溶解度随温度的升高而增大 | |
| C. | 20℃时,100 g甲的饱和溶液中溶质质量为28.6g | |
| D. | 将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO2和Fe2O3都是氧化物 | |
| B. | 生铁和钢都是铁合金 | |
| C. | 空气和液氧都是混合物 | |
| D. | 金刚石和石墨都是由碳元素组成的单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
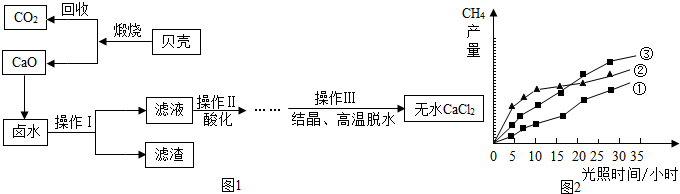
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(1) | 170g | 92.0g | 1.50×10-4g | 33.3g |
| NH3(1) | 86.0g | 97.2g | 0.80g | 0.00g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com