
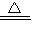 NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl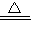 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑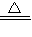 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源:2008年江苏省苏州市初中毕业升学统一考试、化学试卷 题型:022
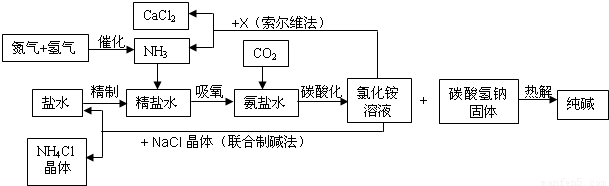
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域.工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱.其流程如下:
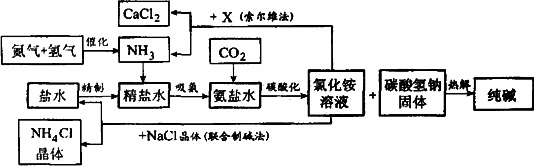
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
②2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
③2NH4Cl+X![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
④NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉积,可以向其一和加入过量纯碱.此时将混合液中不溶物除去的方法是________;溶液中多余的纯碱可以加________试剂来除去.
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要加压条件的原因是:________.
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化镀溶液中加入物质X________(填化学式),产生了可循环使用的氢气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的________,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用.
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答:__________________.
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
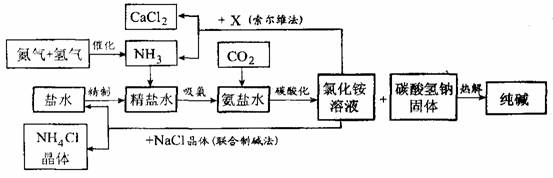
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl
②2NaHCO3![]() Na2CO3+ H2O+CO2↑
Na2CO3+ H2O+CO2↑
③2NH4Cl +X![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
④NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的Ca2+、Mg2+等沉积,可以向其一和加入过量纯碱.此时将混合液中不溶物除去的方法是 ;溶液中多余的纯碱可以加 试剂来除去。
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:
_________ 。
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氢气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的 ,使氯化铵晶体单独析出得到另一种产品――氮肥.氯化钠溶液则可以循环利用。
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
查看答案和解析>>
科目:初中化学 来源:2008年江苏省苏州市中考化学试卷(解析版) 题型:填空题

 NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com