
一包不纯的Na2CO3固体,其杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种.现取该样品,溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断正确的是( )
| A.加水得澄清溶液,样品中一定没有CaCl2 |
| B.样品中一定含有NaHCO3,可能含有NaCl |
| C.样品中一定含有NaCl,可能含有NaHCO3 |
| D.所加的稀盐酸溶质质量分数不大于7.3% |
ACD
解析试题分析:由于碳酸钠和氯化钙能够生成白色的碳酸钙沉淀,而取该样品,溶于水得到澄清溶液,所以固体中一定不会含有氯化钙,假设该固体都是碳酸钠,则设生成的二氧化碳的质量是x反应的氯化氢的质量是y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
10.6g y x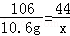 =
=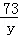
x=4.4g y=7.3g
由于杂质是碳酸氢钠也能生成二氧化碳,且碳酸氢钠的相对分子质量比碳酸钠小,所以同质量的碳酸氢钠比碳酸钠生成的二氧化碳要多,故杂质中不能全部是碳酸氢钠,故还一定含有氯化钠,且杂质可以全部是氯化钠,也可以是氯化钠和碳酸氢钠两者都有;
如果该固体全部是碳酸钠,此时盐酸的溶质质量分数是 ×100%=7.3%,而反应中的二氧化碳小于4.4g,所以消耗的氯化氢应该比此时要少,所以所加的稀盐酸溶质质量分数不大于7.3%;
×100%=7.3%,而反应中的二氧化碳小于4.4g,所以消耗的氯化氢应该比此时要少,所以所加的稀盐酸溶质质量分数不大于7.3%;
故选ACD
考点:物质的鉴别、推断;酸的化学性质;根据化学反应方程式的计算.
点评:熟练掌握碳酸盐的性质,学会利用利用极端假设法来解答这类题目:先假设全部是主要的物质,然后根据计算的数据,判断是否含有其他的物质,这是解答此题的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:初中化学 来源: 题型:探究题
如图是实验室常用的两种气体制备、收集、净化的多种功能装置.请完成下列各题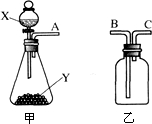
(1)若制备的气体是氢气,且产生的气体中不含酸性杂质气体,则试剂X常用 ;
(2)若X是过氧化氢溶液,Y是二氧化锰,将装置甲和乙通过A、C相连来制取气体,检查装置气密性后,还须将装置乙 ;
(3)为测定黄铜(Cu和Zn)中锌的质量分数,某化学小组只用甲装置:称取ag黄铜与足量的盐酸反应。欲计算黄铜中锌的质量分数,还须测定的数据有 。
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
将17.4g部分变质的氢氧化钙,加入到200g7.3%的稀盐酸中,恰好完全反应,则所得溶液中溶质的质量为
| A.11.1g | B.14.2g | C.22.2g | D.44.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
在某H2O2溶液中氢元素与氧元素的质量比为2:17,现向19g该H2O2溶液中加入1g二氧化锰,充分反应后,生成氧气的质量为
( )
| A.1g | B.1.6g | C.4.2g | D.8.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合如图所示的质量关系.(不计损耗)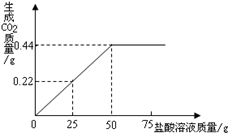
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
化学在防治大气污染和水污染等方面发挥了重要作用,使更多地化学生产工艺和产品向着环境友好的方向发展.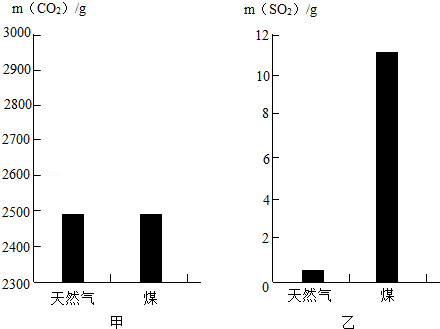
(1)为从源头消除污染,生产、生活中要选择对环境影响小的燃料,已知充分燃烧1kg天然气和煤所产生的CO2和SO2气体的质量如图所示,则 燃烧产生的气体更易导致酸雨.
(2)某火力发电厂为了防止环境污染,需将废气中的二氧化硫进行处理,其发生的主要反应为2CaCO3+2SO2+O2=2CaSO4+2CO2,若100g废气中含有1.6g二氧化硫,则处理1000g这种废气需含碳酸钙80%的石灰石 g.
(3)某工厂以流量10L/s(升/秒)排出含硫酸9.8%的工业废水,现向该废水中排入含氢氧化钠2%的工业废水,与硫酸反应后再排出,要使处理后的废水呈中性,则含氢氧化钠2%的工业废水的流量应为 L/s(上述含酸废水和含碱废水的密度均近似为1g/cm3).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 ;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答: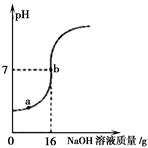
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com