
【题目】某课外活动中,学生利用下图所示的材料完成探究实验,杠杆已调至平衡。

(1)实验1中,较长时间后,左边铁粉布包下降,是因为铁粉与_________发生了反应。将铁粉换成下列物质中的________(填序号),杠杆也会出现相似现象。
A.NaCl B.NaOH C.CaO
(2)实验2中,通入CO2一段时间,右边乒乓球___________(填“上升”或“下降”)。再往集气瓶中滴入足量NaOH溶液,杠杆重新平衡,发生反应的化学方程式为_____________________________。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】填字游戏是一种智力游戏。现有铁、二氧化碳、硫酸、氢氧化钠和碳酸钠五种物质,请将它们分别填到ABCDE中,使它们之间能相互反应或转化。说明:“—”表示反应,“→”表示转化,“…”表示不反应。
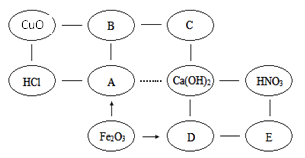
(1)写出Ca(OH)2和HNO3反应的化学方程式_______________,反应基本类型为_________反应,也叫__________反应。
(2)C物质的化学式___________;CuO和足量B反应的现象是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】单晶硅是信息技术和新能源开发的基础材料。硅元素的原子结构示意图及其在元素周期表中的信息如图所示。下列说法错误的是( )
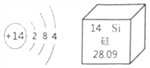
A. 硅原子的质子数为14 B. 硅元素为非金属元素
C. 硅元素的原子质量为28.09g D. 硅元素位于元素周期表中第三周期
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包不纯的碳酸钾粉末,所含杂质可能是硝酸钾、硝酸钙、氯化钾、氯化亚铁、碳酸钠中的一种或几种。为确定其成分,进行如下实验:
(1)取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液。向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失。
(2)另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,生成19.7g白色沉淀。
(资料:稀硝酸与碳酸盐能发生复分解反应,稀硝酸与氯化银不反应)
下列说法正确的是
A. 杂质中一定不含有氯化亚铁
B. 杂质中一定含有氯化钾,可能含有硝酸钾、碳酸钠
C. 该包粉末的组成只有两种情况
D. 所用氯化钡溶液中溶质的质量分数为20.8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食醋是厨房中常用的調味品,其中含有醋酸。醋酸的化学式为CH3COOH,请回答:
(1)醋酸属于_____化合物(填“有机”或“无机”)。
(2)醋酸的相对分子质量是_______;
(3)醋酸中碳、氢两种元素的质量比是_______;
(4)_____g醋酸中含6.4g氧元素。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]用作农药防治小麦黑穗病。实验室用加热法测定某农药中碱式碳酸铜的质量分数(假设杂质受热不参与反应)。充分加热100g样品,得到固体84.5g。已知反应的化学方程式为:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。试计算:
2CuO+H2O+CO2↑,Cu2(OH)2CO3的相对分子质量为222。试计算:
(1)Cu2(OH)2CO3中质量分数最大的元素是_______。
(2)若用100g 98%的浓硫酸充分吸收反应所产生的水,得到硫酸溶液的溶质质量分数是多少_______? (计算结果精确到0.1%)
(3)样品中碱式碳酸铜的质量分数是多少______________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中,图一为四种物质的溶解度曲线,在图二中分别向两支试管内滴加一定量的水后,X和Y的饱和溶液均变混浊,则下列说法错误的是

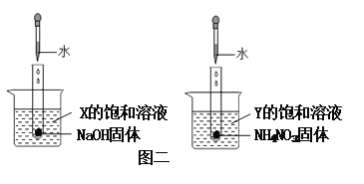
A. 10℃时,物质溶解度大小关系为:①>③>②>④
B. X为Ce2(SO4)3,Y不一定是NH4H2PO4
C. 若NHH2PO4中混有少量的NaCl杂质,可在较高温度配成饱和溶液,再降温结晶除去
D. 20℃时,将40NaCl加入到100g水中,所得溶液中溶质和溶剂的质量比是2:5
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示的四个图象,能正确反映对应变化关系的是
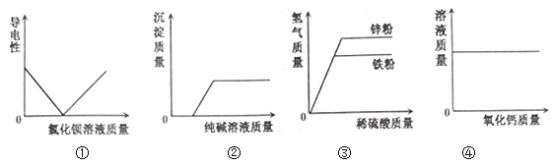
A. ①向硫酸钠溶液中不断加入氯化钡溶液
B. ②向盐酸、氯化钙混合溶液中逐滴加入纯碱溶液
C. ③向等质量的锌粉、铁粉中分别加入足量同种稀硫酸
D. ④向一定温度的饱和氢氧化钙溶液中不断加入氧化钙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) | 0 | 20 | 25 | 40 | 50 | 60 | 80 |
溶解度(g) | 69.2 | 74.5 | 76.4 | 81.8 | 85.5 | 89.4 | 98.0 |
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com