
| A. | 用排气法收集二氧化碳时,应将燃着的木条放在集气瓶口验满 | |
| B. | 洗干净的玻璃仪器的内壁附着的水既不会聚成水滴,也不会成股流下 | |
| C. | 加热高锰酸钾并用排水法收集氧气,只要导管口有气泡产生就立即收集 | |
| D. | 做铁丝在氧气中燃烧实验时,应预先在集气瓶中留少量水或铺少量的细沙 |
分析 A、根据二氧化碳的性质(本身不燃烧,也不支持燃烧)来作答;
B、根据玻璃仪器洗净的标志考虑;
C、从实验的误差方面考虑;
D、从实验的安全角度去考虑
解答 解:A、因为二氧化碳不燃烧且不支持燃烧,可使燃着的木条熄灭,因此可把燃着的木条放在集气瓶口来验满;故本选项正确;
B、洗干净的玻璃仪器的内壁附着的水既不会聚成水滴,也不会成股流下,故本选项正确;
C、加热高锰酸钾并用排水法收集氧气,不能立即收集.因为收集的气体不纯净,当气泡均匀连续放出时,就可以收集了.故本选项错误;
D、做铁丝在氧气中燃烧实验时,应预先在集气瓶中留少量水或铺少量的细沙的作用是防止灼热的生成物溅落下来炸裂瓶底.故本选项正确;
故选C.
点评 本题综合考查了二氧化碳、氧气的验满与检验,制取氧气的操作步骤和注意点,一氧化碳还原氧化铁.通过本题是训练,提醒了学生在操作实验时需注意的事项.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成的 | |
| B. | 原子中不存在带电的粒子,所以原子不显电性 | |
| C. | 原子是化学变化中的最小粒子 | |
| D. | 原子中质子数一定等于中子数 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
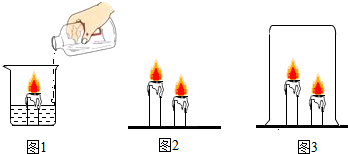
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 过碳酸钠的水溶液能使无色酚酞变红,所以过碳酸钠是一种碱 | |
| B. | 过碳酸钠(Na2CO4)漂白杀菌时,发生了化学变化 | |
| C. | 过碳酸钠(Na2CO4)中碳元素的化合价为+4价 | |
| D. | 取2.8g样品与足量稀盐酸反应,只要测定反应中产生的CO2体积,就可推算出过碳酸钠的纯度 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
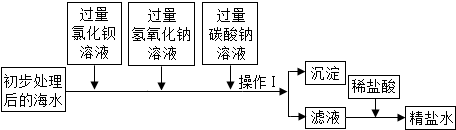
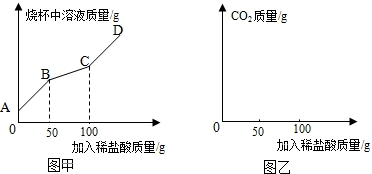
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com