
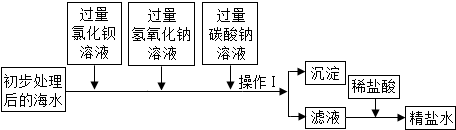
分析 (一)根据除杂的原则,利用复分解反应将杂质离子镁离子、钙离子、硫酸根离子和新增的钡离子一一转化成沉淀除去,经过滤后再利用稀盐酸 将过量的氢氧化钠和碳酸钠除去;
(二)(1)由碳酸氢钠加热反应制取碳酸钠的同时生成水和二氧化碳,写化学方程式;
(2)欲知纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么;
(三)(1)从题意用玻璃棒搅拌能减小实验误差来分析;
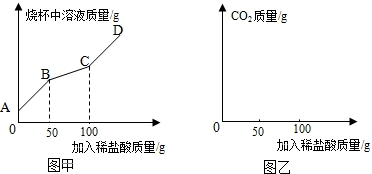
(2)计算出开始产生二氧化碳的点和不再产生二氧化碳的点即可绘得变化的曲线;
(3)要计算碳酸钠的质量分数,需要求得碳酸钠的质量.
解答 解:(1)海水中存在的杂质离子有硫酸根离子、镁离子和钙离子,可通过加入氯化钡、氢氧化钠和碳酸钠逐一转化成沉淀除去,故加氢氧化钠的目的是:除去海水中的氯化镁;
故答案是:除去海水中的氯化镁;
(2)根据操作Ⅰ后的物质分类(沉淀和滤液)知,该步骤的名称为:过滤;
故答案是:过滤;
(3)因硫酸根离子与钡离子会生成硫酸钡沉淀,镁离子与氢氧根离子生成氢氧化镁沉淀,钙离子与碳酸根离子生成碳酸钙沉淀,又因碳酸钠还能与过量的除杂试剂氯化钡反应生成硫酸钡沉淀,故过滤后的沉淀物有:硫酸钡、氢氧化镁、碳酸钙和硫酸钡;
故答案是:CaCO3、BaCO3
(4)加稀盐酸的目的是除去过量的试剂氢氧化钠和碳酸钠以得到精盐水;
故答案是:除去滤液中的NaOH和Na2CO3
(二)(1)碳酸氢钠受热后分解为碳酸钠、水和二氧化碳,其反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
故答案是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有氯离子,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl;
故答案为:NaCl;
(三)(1)从用玻璃棒搅拌能减小实验误差的角度看,应该是促使纯碱与盐酸充分反应,同时有利于二氧化碳的逸散.
故答案是:促使纯碱与盐酸充分反应,同时有利于二氧化碳的散逸;
(2)据图甲可以看出,当加入盐酸的量为50g时开始产生二氧化碳,当加入盐酸的量为100g时不再生成二氧化碳,设产生二氧化碳的质量为x,则有
NaHCO3+HCl=NaCl+H2O+CO2↑.
36.5 44
50g×14.6% x
36.5:50g×14.6%=44:x
解得,x=8.8g
所以本题答案为: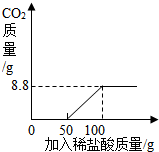
(3)根据题意可以看出,与碳酸钠反应的盐酸共有100g,设碳酸钠的质量为y,则有
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
y 100g×14.6%
$\frac{106}{y}=\frac{73}{100g×14.6%}$
解得,y=21.2g,
所以该样品中纯碱的质量分数为:$\frac{21.2g}{22g}$×100%=96.4%
答:该样品中纯碱的质量分数96.4%.
点评 弄清图甲曲线中各个转折点的意义是解答本题的关键,由反应过程的详细情况合理地分析出曲线上点的含义,从而来理解出在滴入的稀盐酸的质量为50g时才产生二氧化碳气体,原来的盐酸是参与了Na2CO3+HCl═NaHCO3+NaCl反应,当滴入的盐酸质量为100g时,产生二氧化碳气体的量最多,也即完全反应,根据化学反应计算出CO2的质量为8.8g,从而画出图象;本题运用结合图象解决问题难度较大,要求学生的基本功很扎实.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
 未经处理的工业废水会严重污染水和土壤,某种新型催化剂可有效降解工业废水中的有机污染物.为探究该催化剂降解有机污染物的速度受哪些因素影响,学习小组进行了如下实验.
未经处理的工业废水会严重污染水和土壤,某种新型催化剂可有效降解工业废水中的有机污染物.为探究该催化剂降解有机污染物的速度受哪些因素影响,学习小组进行了如下实验.| 时间/分 有机物被降解百分比/% 组别 | 0 | 5 | 10 | 15 |
| A | 0 | 20 | 40 | 60 |
| B | 0 | 40 | 80 | 100 |
| C | 0 | 30 | 60 | 90 |
| D | 0 | 0 | 0 | 0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用排气法收集二氧化碳时,应将燃着的木条放在集气瓶口验满 | |
| B. | 洗干净的玻璃仪器的内壁附着的水既不会聚成水滴,也不会成股流下 | |
| C. | 加热高锰酸钾并用排水法收集氧气,只要导管口有气泡产生就立即收集 | |
| D. | 做铁丝在氧气中燃烧实验时,应预先在集气瓶中留少量水或铺少量的细沙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在某些工业生产过程中,将欲排放的CO2用化学试剂吸收 | |
| B. | 禁止制备和使用CH4和氮氧化合物等温室气体 | |
| C. | 开发无污染的太阳能、风能、地热能等 | |
| D. | 变革能源消耗模式 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | A | B | C | D |
| 反应前质量/g | 20 | 12 | 2 | 6 |
| 反应后质量/g | 0 | 2 | 2 | 待测 |
| A. | 该反应是分解反应 | B. | 反应后D物质的质量是30 g | ||
| C. | C物质可能是该反应的催化剂 | D. | B物质全部参加反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
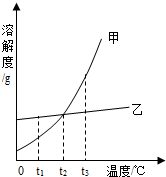 如图是甲、乙两种固体物质的溶解度曲线图.下列说法中正确的是( )
如图是甲、乙两种固体物质的溶解度曲线图.下列说法中正确的是( )| A. | t2℃时,甲、乙两种物质溶液的溶质质量分数一定相等 | |
| B. | t3℃时,将甲、乙的饱和溶液都蒸发掉 10g水,析出甲的晶体质量比析出乙的晶体质量大 | |
| C. | 若甲中混有少量乙,可采用蒸发结晶的方法提纯甲 | |
| D. | t1℃时,把甲的不饱和溶液变为饱和溶液,溶剂质量一定不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 取0.5gCaCO3粉末于试管中,加入过量稀盐酸,充分振荡,粉末消失且有气泡产生 | |
| B. | 取0.5gCaCO3粉末于试管中,加入过量硫酸,充分振荡后,产生少许气泡,粉末未消失 | |
| C. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴入酚酞试液,立即变红 | |
| D. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴加10%NaOH溶液,无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com