
| 物 质 | A | B | C | D |
| 反应前质量/g | 20 | 12 | 2 | 6 |
| 反应后质量/g | 0 | 2 | 2 | 待测 |
| A. | 该反应是分解反应 | B. | 反应后D物质的质量是30 g | ||
| C. | C物质可能是该反应的催化剂 | D. | B物质全部参加反应 |
分析 本题可分析A、B、C三种物质反应前后的质量变化情况,确定是反应物还是生成物;然后根据质量守恒定律确定D是反应物还是生成物,结合题意进行分析判断即可.
解答 解:由表中数据分析可知,反应前后A的质量减少了20g-0g=20g,故A是反应物,参加反应的A的质量为20g;同理可以确定B是反应物,参加反应的B的质量为12g-2g=10g;C的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,D应是生成物,且生成的D的质量为20g+10g=30g.
A、该反应的反应物为A和B,生成物是D,符合“多变一”的特征,属于化合反应,故选项说法错误.
B、生成的D的质量为30g,反应后D物质的质量是30g+6g=36g,故选项说法错误.
C、C的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确.
D、B物质还有剩余,没有全部参加反应,故该选项错误.
故选:C.
点评 本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据,灵活运用质量守恒定律.


科目:初中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成的 | |
| B. | 原子中不存在带电的粒子,所以原子不显电性 | |
| C. | 原子是化学变化中的最小粒子 | |
| D. | 原子中质子数一定等于中子数 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 过碳酸钠的水溶液能使无色酚酞变红,所以过碳酸钠是一种碱 | |
| B. | 过碳酸钠(Na2CO4)漂白杀菌时,发生了化学变化 | |
| C. | 过碳酸钠(Na2CO4)中碳元素的化合价为+4价 | |
| D. | 取2.8g样品与足量稀盐酸反应,只要测定反应中产生的CO2体积,就可推算出过碳酸钠的纯度 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
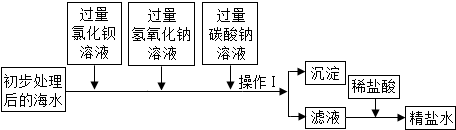
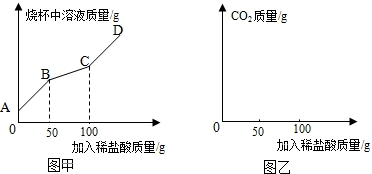
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
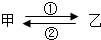 甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.
甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
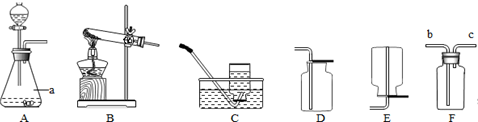
| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 探究一:固体M是否失效 | 取适量固体M,加入盛有水的烧杯中,用温度计测量加入前后的温度 | 温度没有明显 变化 | 说明没有氧化钙 |
| 探究二:固体M中是否含有氢氧化钙 | 将上述烧杯内的液体充分搅拌、静置,取上层清液,加入无色酚酞试液 | 酚酞试液变红 | 有氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com