
 未经处理的工业废水会严重污染水和土壤,某种新型催化剂可有效降解工业废水中的有机污染物.为探究该催化剂降解有机污染物的速度受哪些因素影响,学习小组进行了如下实验.
未经处理的工业废水会严重污染水和土壤,某种新型催化剂可有效降解工业废水中的有机污染物.为探究该催化剂降解有机污染物的速度受哪些因素影响,学习小组进行了如下实验.| 时间/分 有机物被降解百分比/% 组别 | 0 | 5 | 10 | 15 |
| A | 0 | 20 | 40 | 60 |
| B | 0 | 40 | 80 | 100 |
| C | 0 | 30 | 60 | 90 |
| D | 0 | 0 | 0 | 0 |
分析 (1)根据A和D组中温度相同,pH值不同进行分析;
(2)根据题中的数据进行分析;
(3)根据题中的数据可以看出,增大pH值可以使反应速率减慢进行分析.
解答 解:(1)通过分析可知,A和D组中温度相同,pH值不同,所以实验中设置A和D组的目的是探究pH对降解反应速度的影响;
(2)A组实验在0-5分,降解了10%,5-10分,降解了30%,在10-15分,降解了20%,
B组实验在0-5分,降解了40%,5-10分,降解了40%,在10-15分,降解了20%,
C组实验在0-5分,降解了30%,5-10分,降解了30%,在10-15分,降解了30%,
所以实验A,B,C三组结果表明,当pH相等时,温度升高,降解反应速度先增大后减小;
(3)增大pH值可以使反应速率减慢,所以实验中若要测定某一时刻有机物被降解的百分比,需要迅速把试管中液体的pH调到10,这样做的目的是使反应立即停止.
故答案为:
(1)pH;
(2)当pH相等时,温度升高,降解反应速度先增大后减小;
(3)使反应立即停止.
点评 在解此类题时,首先分析题中考查的问题,然后转化成自己熟悉的知识进行解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
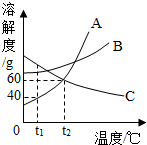 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,并不断振荡 | 有白色沉淀生成 | 说明原溶液中一定含有 Na2CO3(填化学式) |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液 | 溶液变为红色 | 说明原溶液中一定含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 抗强冲击性 | B. | 抗穿透性 | C. | 抗高温火烧 | D. | 抗深海压力 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成的 | |
| B. | 原子中不存在带电的粒子,所以原子不显电性 | |
| C. | 原子是化学变化中的最小粒子 | |
| D. | 原子中质子数一定等于中子数 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com