
| A. | 取0.5gCaCO3粉末于试管中,加入过量稀盐酸,充分振荡,粉末消失且有气泡产生 | |
| B. | 取0.5gCaCO3粉末于试管中,加入过量硫酸,充分振荡后,产生少许气泡,粉末未消失 | |
| C. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴入酚酞试液,立即变红 | |
| D. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴加10%NaOH溶液,无明显现象 |
分析 碳酸钙不是绝对不溶于水,说明含有很少量的碳酸钙,据此解答.
解答 解:A、CaCO3能与稀盐酸反应,向少许CaCO3粉末加入过量稀盐酸充分振荡,粉末消失且有气泡产生,与CaCO3是否溶于水无关,不能证明“CaCO3并非绝对不溶于水”.错误;
B、碳酸钙能与硫酸反应,不能证明CaCO3并非绝对不溶于水,错误;
C、水显中性,不能使酚酞试液变红;向少许CaCO3粉末加入3mL蒸馏水充分振荡,滴入酚酞试液即变红,说明是碳酸钙粉末能溶于水,显碱性,能证明“CaCO3并非绝对不溶于水”.正确;
D、CaCO3不与NaOH溶液反应,向CaCO3粉末加入NaOH溶液充分振荡,无明显现象,不能证明“CaCO3并非绝对不溶于水”.错误;
故选C.
点评 本题有一定难度,考查同学们灵活运用所学知识、化学实验方案设计与评价的能力,掌握碳酸钙的性质是正确解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
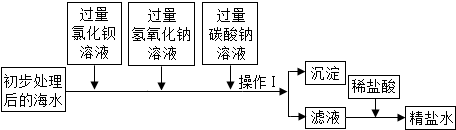
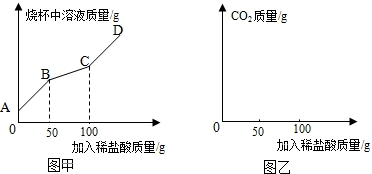
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
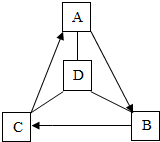 A~D是初中化学常见的物质,它们存在如下图所示的关系(“-”表示两物质间能反应,“→”表示一种物质转化成另一种物质.部分反应物和生成物及反应条件已略去).A、B、C是二种不同类别的含钙化合物,B常用作食品干燥剂.请回答下列问题.
A~D是初中化学常见的物质,它们存在如下图所示的关系(“-”表示两物质间能反应,“→”表示一种物质转化成另一种物质.部分反应物和生成物及反应条件已略去).A、B、C是二种不同类别的含钙化合物,B常用作食品干燥剂.请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 证明含有K2SO3 |
| 3 | 向B试管中,加入氯化钡溶液,再加入足量的稀盐酸; | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
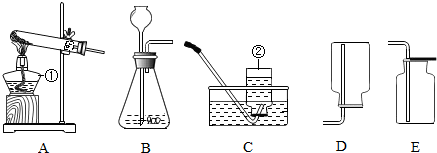
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com