
【题目】根据所学化学知识回答下列问题。
①天然气的主要成分是甲烷(CH4),甲烷属于______(选填“有机”或“无机”)物,其中碳元素以____(选填“游离”或“化合”)态存在;甲烷完全燃烧的化学方程式是___。
②自来水厂净水过程中除去色素和异味用到活性炭,主要利用其______性。
③“中国芯”彰显中国“智”造。芯片的基材主要是高纯硅,工业上利用三氯硅烷(HSiCl3)制取高纯硅。三氯硅烷含有_____种元素,1mol HSiCl3中约含______个氯原子。
④某工业品盐酸的溶质质量分数为37%。“37%”的含义是_____;要配制100g 7.4%的稀盐酸,需要37%的盐酸____g。
【答案】有机 化合 CH4 +2O2![]() CO2 + 2H2O 吸附 3 1.806 ×1024 在100g盐酸(或在100g溶液)中含氯化氢37g 20
CO2 + 2H2O 吸附 3 1.806 ×1024 在100g盐酸(或在100g溶液)中含氯化氢37g 20
【解析】
①天然气的主要成分是甲烷(CH4),是含碳的化合物,甲烷属于有机物,其中碳元素以化合态存在;甲烷完全燃烧生成二氧化碳和水,化学方程式是CH4 +2O2![]() CO2 + 2H2O;
CO2 + 2H2O;
②自来水厂净水过程中除去色素和异味用到活性炭,主要利用其吸附性;
③工业上利用三氯硅烷(HSiCl3)制取高纯硅。三氯硅烷含有三种元素,一个三氯硅烷分子中有3个氯原子,1mol HSiCl3中约含6.02×1023个分子,故含有1.806 ×1024个氯原子;
④某工业品盐酸的溶质质量分数为37%。![]() , “37%”的含义是在100g盐酸(或在100g溶液)中含氯化氢37g;要配制100g 7.4%的稀盐酸,设需要37%的盐酸的质量为x,则:100g ×7.4%=37%x,x=20g。
, “37%”的含义是在100g盐酸(或在100g溶液)中含氯化氢37g;要配制100g 7.4%的稀盐酸,设需要37%的盐酸的质量为x,则:100g ×7.4%=37%x,x=20g。


科目:初中化学 来源: 题型:
【题目】测定氢氧化钠溶液与盐酸反应时的pH,得到如图所示曲线,下列有关判断不正确的是
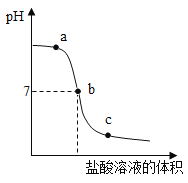
A.实验过程是在氢氧化钠溶液中不断滴加盐酸
B.a点溶液的物质有氢氧化钠,氯化钠和盐酸
C.b点溶液的温度高于a点
D.c点与b点溶液中氯化钠的质量相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息 回答下列问题:

(1)50℃时,乙物质的溶解度是_______________g。
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为____________。
(3)温度为_________℃时,甲、乙两物质溶解度相同。
(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是_____________。
(5)要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数.
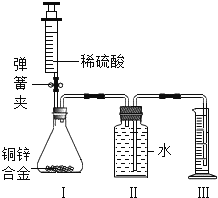
探究过程如下:
①连接实验装置并检查装置气密性.
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL.(注:样品中的杂质不参加反应)
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量1.4g.
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数.
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09g/L.
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为 ,实验过程中须加入稀硫酸至不再产生气体,目的是 .
(2)步骤③中称量剩余固体之前的正确操作是 、洗涤、干燥.
(3)根据实验测定的数据,上述三位同学中 (填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数.
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差.以下因素可能造成偏差的有 (填标号).
A.移出装置Ⅲ时,导管内留存了一部分水
B.实验测量前,没有排除装置Ⅰ中的空气
C.数据处理时,未排除加入稀硫酸所占的体积.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。请回答:
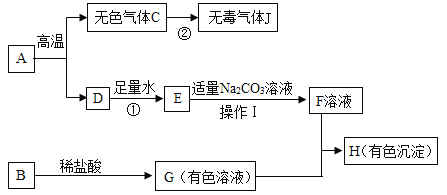
(1)A物质中所含阳离子的符号为_____,物质E的俗名为_____;
(2)得到F溶液的操作Ⅰ的名称为:_____。
(3)写出反应②中气体C转化为气体J的化学方程式:_____;若I是红褐色沉淀,请写出G+F→I的化学方程式:_____。
(4)指出反应①的基本类型是_____反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
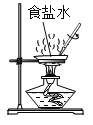
【题目】某兴趣小组运用化学知识进行系列实验。
①如图所示,蒸发食盐水时,玻璃棒的作用是________。
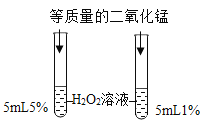
②如图所示,两支试管内产生气泡的速率不同,由此可知影响过氧化氢分解速率的因素是_。
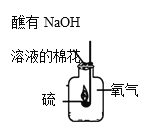
③如图所示,对教材中硫在氧气中燃烧的实验进行了改进,硫在氧气中燃烧的实验现象是___,改进实验的优点是___。
④某同学为了探究相关金属的化学性质,做了下列实验:
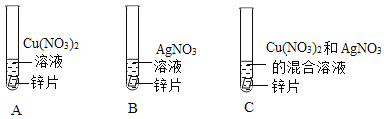
Ⅰ实验a试管中反应的化学方程式为__。
Ⅱ只通过实验a和实验b尚不能证明铜、银的活动性强弱,需补充一个实验来证明,补充实验所用的试剂有___。
Ⅲ实验c中物质充分反应后过滤,滤液为蓝色,则判断正确的是____(填序号)。
A 滤渣中一定有银,可能有铜
B 滤液中一定有硝酸锌、硝酸铜、硝酸银
C 滤渣中一定有银和锌,可能有铜
D 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质由微粒构成。化学反应过程中某些微粒会发生改变,而有些微粒则不会发生改变。
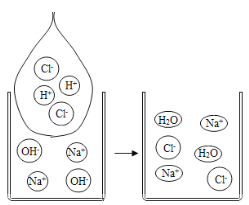
(1)以下是氢氧化钠和盐酸的反应的微观示意图,发生的化学反应方程式为_____,从微观示意图可知,该反应中发生变化的微粒是_____,它们是该反应的“参与者”;未发生变化的微粒是_____,它们是该反应的“旁观者”。
(2)碳酸钠溶液与过量稀盐酸混合后的化学反应方程式为_____,实际参加反应的微粒是_____。
(3)铁与硫酸铜溶液的反应中,溶液中实际参加反应的微粒是_____,溶液中的“旁观者”是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增、人类欲望的无限上升和生产生活方式的无节制,世界气候面临越来越严重的问题,二氧化碳排放量越来越大,全球灾难性气候变化屡屡出现,已经严重危害到人类的生存环境和健康安全。以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福。
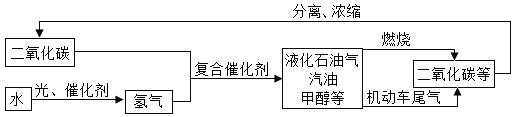
根据上述流程回答下列问题:
(1)上述流程中可循环利用的物质是___________。
(2)“低碳”是全世界的主题,这里的“碳”主要是指_____________气体。
(3)甲醇(CH3OH)完全燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,发生反应的化学方程式为_______________。
(4)证明液化石油气、汽油、甲醇等燃料燃烧产物中含有二氧化碳的方法是(用化学方程式表示)_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
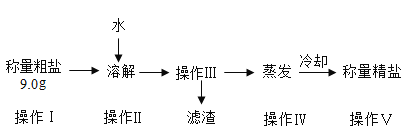
【题目】某小组同学欲提纯粗盐(只含氯化钠和少量泥沙)样品,实验过程和氯化钠的溶解度数据如下。
温度(°C) | 10 | 20 | 30 | 40 | 60 |
溶解度/g/100g水 | 35.8 | 36.0 | 36.1 | 36.4 | 37.1 |
(1)30°C时氯化钠的溶解度是______________。
(2)操作Ⅲ的名称是______________,其原理是依据_____________的性质进行提纯。
(3)最终提纯所得精盐质量偏少,可能的原因是______________ (选填编号)。
a 操作II中食盐未完全溶解就进行操作Ⅲ
b 操作Ⅲ中有滤渣漏入承接液体的烧杯
c 操作II、IV实验过程中有物质溅出
d 操作IV蒸发最终所得精盐比较潮湿
(4)溶解粗盐时,加入20°C水合适的量约为_____________(选填“20”、“30” 或“50”) mL。
(5)称取4.5g提纯的精盐,可配制质量分数为0.9%的食盐溶液______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com