
 如图是对生成氯化钠反应关系的归纳与整理.请回答下列问题:
如图是对生成氯化钠反应关系的归纳与整理.请回答下列问题:分析 (1)根据酸能与碱发生中和反应,盐酸能与氢氧化钠溶液反应生成氯化钠和水,据此进行分析解答.
(2)反应④是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,写出反应的化学方程式即可.
(3)根据NaHCO3的用途进行分析解答.
(4)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量.
解答 解:(1)盐酸能与氢氧化钠溶液反应生成氯化钠和水,物质A是常见的碱,A为氢氧化钠,其化学式为:NaOH.
(2)反应④是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)碳酸氢钠能与胃液中的盐反应,NaHCO3在医疗上可用于治疗胃酸过多.
(4)溶质质量=溶液质量×溶质的质量分数,配制200g 8%的NaCl溶液,需氯化钠的质量=200g×8%=16g;溶剂质量=溶液质量-溶质质量,则所需水的质量=200g-16g=184g.
配制过程中为了加快NaCl的溶解,可用玻璃棒进行搅拌.
故答案为:(1)NaOH;(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;(3)治疗胃酸过多;(4)184;用玻璃棒进行搅拌.
点评 本题难度不大,掌握酸的化学性质、盐的化学性质、化学方程式的书写等是正确解答本题的关键.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:解答题
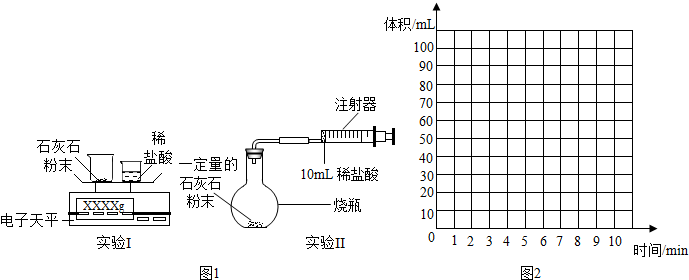
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
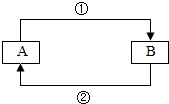 A、B是同学们在初中阶段学习化学过程中常会遇到的物质,在一定的条件下,它们之间相互转化的关系可用如图表示.
A、B是同学们在初中阶段学习化学过程中常会遇到的物质,在一定的条件下,它们之间相互转化的关系可用如图表示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 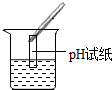 | 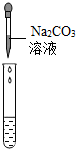 | 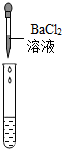 |
| 实验现象 | 试纸变色,比照比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中只有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠易溶于水 | B. | 氢氧化钠易潮解、变质 | ||
| C. | 氢氧化钠易挥发 | D. | 氢氧化钠溶于水会放出大量的热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com