
| 空气中二氧化碳的体积分数 | 对人体健康的影响 |
| 1% | 感到气闷、头昏、心悸 |
| 4%-5% | 感到气闷、头痛、眩晕 |
| 10% | 使人神志不清、呼吸停止、以致死亡 |
| 空气中二氧化碳体积分数 | 0.03% | 1% | 5% | 10% | 20% |
| 方法一 | 正常燃烧 | 正常燃烧 | 正常燃烧 | 燃烧不旺 | 熄灭 |
| 方法二 | 不变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 |


科目:初中化学 来源: 题型:阅读理解
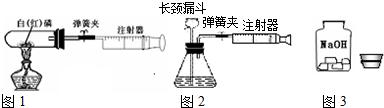

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
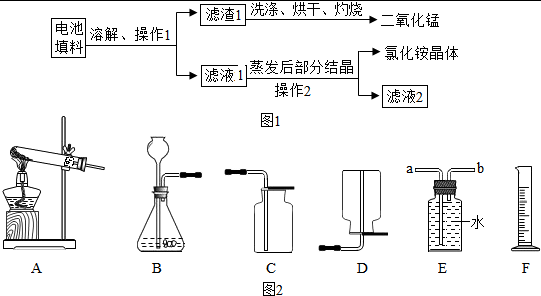
| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 小刚查阅资料得知
小刚查阅资料得知查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
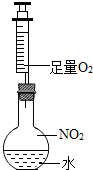 小刚查阅资料得知
小刚查阅资料得知查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com