
| A、①② | B、③⑤⑥ |
| C、②④⑥ | D、①②③④⑤ |


科目:初中化学 来源: 题型:
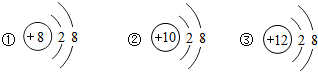
| A、①②③原子的核外电子数都相同 |
| B、①②③都属于稳定结构 |
| C、①②③都是原子失去电子形成的离子 |
| D、①②③都不显电性 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、只含碳、氢元素 |
| B、含碳氢氧三种元素 |
| C、化学式为C2H6O |
| D、化学式为CH4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、利用化学生产化肥和农药,以增加粮食的产量 |
| B、利用化学合成药物,以抑制细菌和病毒,保障人体健康 |
| C、利用化学开发新能源和新材料,以改善人类的生存条件 |
| D、化石燃料的直接利用,促进了低碳经济的发展 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 |
| B、酸和碱的溶液能与指示剂反应,所以所有的酸和碱都能使指示剂变色 |
| C、盐是由金属离子和酸根离子构成的,NH4NO3中没有金属离子,不属于盐 |
| D、盐酸溶液、硫酸溶液都能使石蕊试液变红,所以硝酸溶液也能使石蕊试液变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、CO2气体(H2O)→固体氢氧化钠 |
| B、KNO3溶液(NaCl)→降温结晶 |
| C、C (CuO)→稀硫酸 |
| D、CO气体(CO2)→氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com