

| ||
| ||


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答:
(2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答:
| ||
| ||
| 7.3g |
| 192.7g-0.018g+7.3g |
| 7.3g |
| 192.7g-0.018g+7.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
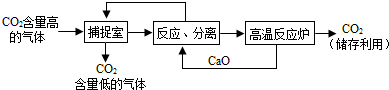
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com